Журнал "віч-інфекція та імуносупресії". ВІЛ-інфекція та імуносупресії = HIV infection and immunosuppressive disorders: науково-практичний журнал, що рецензується Приблизний пошук слова
Лихоманка неясного генезу часто спостерігають у пацієнтів, інфікованих ВІЛ, і у хворих, які отримують тривалу імуносупресивну терапію як профілактику відторгнення трансплантату або в рамках лікування аутоімунних захворювань або системних захворювань сполучної тканини.
Використовують усі діагностичні можливості, описані вище (див. табл. 20-1), однак у цієї категорії пацієнтів часто виникають рідкісні опортуністичні інфекції. Крім того, ВІЛ-інфіковані та пацієнти, які отримують імуносупресивну терапію, більш схильні до розвитку деяких злоякісних новоутворень, при яких також може виникати ЛНГ. Найбільш поширені діагнози представлені у табл. 20-3. Більшість інфекційних захворювань, такі як токсоплазмоз головного мозку, пневмоцистний або криптококовий менінгіт, мають характерну клінічну картину, що дозволяє відразу виставити діагноз. Інші захворювання, першим симптомом яких часто стає ЛНГ, обговорено нижче.
Піогенні абсцесиможуть формуватися будь-де. При СНІД вони нерідко мають незвичайну локалізацію, наприклад, у простаті або в придаткових пазухах носа. При об'єктивному огляді та під час діагностики слід виключати ці причини.
Інфекція Mycobacterium tuberculosis, як правило, маніфестує лихоманкою у поєднанні з кашлем та втратою маси тіла. На рентгенограмі органів грудної клітки виявляють інфільтрати в легеневій тканині. Найчастіше спостерігають позалегеневе ураження, проте на рентгенограмі менш виражений фіброз та кавернізація порівняно з хворими з нормальним рівнем імунітету. Посів мокротиння нерідко негативний.
Mycobacterium avium-intracellulare- Найчастіша причина ЛНГ на важких стадіях СНІДу, яку виявляють у 10-20% хворих. Воротами інфекції стає ШКТ. Збудник дисемінує по кровоносному руслу і виявляється у печінці, кістковому мозку та лімфатичних вузлах. Клінічну картину характеризують коливання температури та озноби. Діагностика заснована на результатах спеціального посіву крові, посіву калу, кісткового мозку та біопсії печінки.
Неходжкінська лімфоматакож нерідко стає причиною ЛНГ на пізніх стадіях СНІДу. Лімфома може формуватися будь-де. У пацієнтів зі СНІДом, як правило, виявляють широке збільшення лімфатичних вузлів, що ускладнює діагностику лише на підставі клінічної картини. Для підтвердження діагнозу необхідна біопсія збільшених вузлів, КТ органів черевної порожнини та біопсія кісткового мозку.
Стійка лихоманка неясного генезувиникає на пізній стадії СНІДу і може зберігатися протягом кількох місяців. Часто проводять спроби лікування інфекції Mycobacterium avium-intracellulare та піогенних інфекцій, які зазвичай не дають результату, тому призначають симптоматичну терапію нестероїдними та стероїдними препаратами.
Журнал «ВІЛ-інфекція та імуносупресії» є першим, регулярно виходить у світ офіційно зареєстрованим у Російській Федерації періодичним науково-практичним рецензованим виданням. У журналі з 2009 р. публікується інформація про основні питання в галузі ВІЛ-інфекції в рамках великої кількості медичних спеціальностей - акушерство та гінекологія, внутрішні хвороби, педіатрія, інфекційні хвороби, шкірні та венеричні хвороби, нервові хвороби, онкологія, фтизія і переливання крові, наркологія, епідеміологія, громадське здоров'я та охорона здоров'я, соціологія медицини, патологічна анатомія, фармакологія, клінічна фармакологія, клінічна імунологія, алергологія, клінічна лабораторна діагностика та ін., а також зачіпає суміжні області народонаселення, демографія, вивчення населення, соціологія, соціально-медична допомога, особи, які потребують допомоги, економіка.
До основних розділів журналу належать:
- Фундаментальні та прикладні питання імуносупресій
- Вірусологічні, патофізіологічні та морфологічні питання ВІЛ-інфекції
- Епідеміологія та гігієна ВІЛ-інфекції
- Клінічні аспекти ВІЛ-інфекції, фармакотерапія та паліативна допомога
- Оппортуністичні, вторинні та супутні інфекції та захворювання при ВІЛ-інфекції
- Діагностика, лабораторна служба
- Організація медичної допомоги та суміжні питання ВІЛ-інфекції
- Наркологія та ВІЛ-інфекція
- Питання материнства та дитинства
- Питання соціальної та медичної психології, сестринська справа
- Питання безпеки у гемотрансфузіології
- Освіта в галузі ВІЛ-інфекції та імунології
- Останні досягнення та хроніка заходів у галузі ВІЛ-інфекції та імуносупресії
Цільова читацька аудиторія журналу: вчені, які займаються фундаментальними дослідженнями; лікарі різних спеціальностей, біологи та біохіміки, морфологи, медичні психологи та інші фахівці; професорсько-викладацький склад медичних та біологічних вузів, аспіранти та студенти.
Журнал «ВІЛ-інфекція та імуносупресія» видається в Санкт-Петербурзі з 2009 року. У ньому безкоштовно публікуються оригінальні статті, наукові огляди, матеріали дисертацій російською мовою з усіх розділів науки: медичних, біологічних, соціально-економічних та суспільних. Статті рецензуються членами редколегії та редакційної ради – провідними вченими у галузі цих наук. До редакційної колегії журналу входять 15 членів РАН, 29 докторів медичних, біологічних наук та професорів, 3 кандидати медичних наук. Журнал характеризується широкою географією, у ньому опублікували результати своїх досліджень автори, які репрезентують різні регіони Російської Федерації. Ряд публікацій представлений іноземними авторами, підготовленими самостійно або під час реалізації різних спільних наукових проектів із вітчизняними вченими.
Журнал зареєстрований у Міністерстві Російської Федерації у справах друку, телерадіомовлення та засобів масових комунікацій, Свідоцтво про реєстрацію ПІ №ФС77-38240 від 26.11.2009 р.
Журнал включено до міжнародного переліку періодичних видань, ISSN 2077-9328.
Розповсюдження журналу для передплатників друкованої версії здійснюється через: Агентство "Росдрук" - індекс для підписки 57990; Об'єднаний каталог "Преса Росії" - індекс для підписки 42178, періодичність - 1 раз на квартал (4 номери на рік). Журнал може надсилатися післяплатою. Довідки про передплату: тел. +7 921-956-92-55
Повнотекстова електронна версія доступна за підпискою із сайту наукової електронної бібліотеки http://elibrary.ru
- Федеральної державної бюджетної установи "Науково-дослідний інститут експериментальної медицини" (http://www.iemrams.spb.ru);
- Балтійському медичному освітньому центрі (http://www.bmoc-spb.ru);
- Першому Санкт-Петербурзькому державному медичному університеті ім. акад. І.П. Павлова;
- Санкт-Петербурзького Центру з профілактики та боротьби зі СНІД та інфекційними захворюваннями ().
Електронні номери журналів розміщуються на вказаних сайтах одночасно з випуском друкованих номерів, повний текст відкривається через 12 місяців.
Головний редактор- академік РАН Н.А. Біляков
Заступник головного редактора– академік РАН А.Я.Гріненко
Професор А.Г.Рахманова
Відповідальний секретар журналу– к.м.н. В.В.Расохін
Редакція журналу
Головний редактор
Біляков Микола Олексійович- д.м.н., професор, з.д.н. РФ, академік РАН, керівник Санкт-Петербурзького державного бюджетного закладу охорони здоров'я «Центр з профілактики та боротьби зі СНІД та інфекційними захворюваннями»; завідувач кафедри соціально-значимих інфекцій факультету післядипломної освіти Державної бюджетної освітньої установи вищої професійної освіти «Перший Санкт-Петербурзький Державний медичний університет ім. акад. І.П. Павлова» Міністерства Охорони Здоров'я РФ; завідувач лабораторії екологічної інфектології федеральної державної бюджетної установи «НДІЕМ» СЗО РАМН, Санкт-Петербург
Заступники головного редактораГріненко Олександр Якович- Д.М.Н., професор, академік РАН, заслужений лікар РФ, головний науковий співробітник відділу організації швидкої медичної допомоги Державної бюджетної установи «Санкт-Петербурзький науково-дослідний інститут швидкої допомоги ім. І.І.Джанелідзе, Санкт-Петербург
Рахманова Аза Гасанівна- Д.М.Н., професор, заслужений діяч науки РФ, професор кафедри соціально-значущих інфекцій факультету післядипломної освіти Державної бюджетної освітньої установи вищої професійної освіти «Перший Санкт-Петербурзький Державний медичний університет ім. акад. І.П.Павлова» Міністерства Охорони здоров'я РФ, заступник керівника Санкт-Петербурзького державного бюджетного закладу охорони здоров'я «Центр з профілактики та боротьби зі СНІД та інфекційними захворюваннями», головний інфекціоніст Комітету з охорони здоров'я СПб, Санкт-Петербург
Відповідальний секретарРассохін Вадим Володимирович- к.м.н., в.н.с. відділу екологічної фізіології Федеральної державної бюджетної установи «Науково-дослідний інститут експериментальної медицини» СЗОРАН, заступник керівника Санкт-Петербурзької державної бюджетної установи охорони здоров'я «Центр з профілактики та боротьби зі СНІД та інфекційними захворюваннями», Санкт-Петербург
Відповідальний секретар бібліотеки журналуВиноградова Тетяна Миколаївна– к.м.н. заступник керівника Санкт-Петербурзького державного бюджетного закладу охорони здоров'я «Центр із профілактики та боротьби зі СНІД та інфекційними захворюваннями», доцент кафедри соціально-значимих інфекцій Державної бюджетної освітньої установи вищої професійної освіти «Перший Санкт-Петербурзький Державний медичний університет ім. акад. І.П.Павлова» Міністерства Охорони Здоров'я РФ, Санкт-Петербург
Редакційна колегія журналуАйламазян Едуард Карпович- д.м.н., професор, з.д.н. РФ, академік РАН, директор Федеральної державної бюджетної установи «Науково-дослідний інститут акушерства та гінекології ім. Д.О.Отта», Санкт-Петербург
Бобкова Марина Рідівна– д.б.н., професор, зав. лабораторією вірусів лейкозів Федеральної державної бюджетної установи «Науково-дослідний інститут вірусології ім. Д.І.Івановського» Міністерства Охорони Здоров'я РФ, Москва
Бубнова Людмила Миколаївна– д.м.н., професор, керівник Республіканського центру імунологічного типування тканин Федеральної державної бюджетної установи «Російський науково-дослідний інститут гематології та трансфузіології Федерального медико-біологічного агентства Росії», Санкт-Петербург
Вебер Віктор Робертович– д.м.н., професор, член-кореспондент РАМН, ректор Федеральної державної бюджетної освітньої установи вищої професійної освіти «Новгородський державний університет імені Ярослава Мудрого» Великий Новгород
Ді Кліменте Ральф– Ph.D., професор Університету Еморі (Rollins School of Public Health Emory University, Atlanta, Georgia), Атланта
Жданов Костянтин Валерійович- Д.М.Н., професор, начальник кафедри інфекційних хвороб Федерального державного бюджетного військового освітнього закладу вищої професійної освіти «Військово-медичної академії ім. С.М. Кірова» Міністерства оборони Російської Федерації, Санкт-Петербург
Жолобов Володимир Євгенович– д.м.н. професор кафедри соціально-значимих інфекцій Державної бюджетної освіти вищої професійної освіти «Перший Санкт-Петербурзький Державний медичний університет ім. акад. І.П. Павлова» Міністерства Охорони Здоров'я РФ, Санкт-Петербург
Захарова Наталія Георгіївна– д.м.н., завідувач відділу фармації Санкт-Петербурзького державного бюджетного закладу охорони здоров'я «Центр з профілактики та боротьби зі СНІД та інфекційними захворюваннями», Санкт-Петербург
Іванов Олександр Костянтинович- Д.М.Н., професор, науковий консультант відділу фтизіопульмонології Федеральної державної бюджетної установи федеральної державної бюджетної установи «Санкт-Петербурзький науково-дослідний інститут фтизіопульмонології» Міністерства Охорони здоров'я РФ, Санкт-Петербург
Кетлінський Сергій Олександрович- Д.Б.Н., професор, член-кореспондент РАМН, зам. директора Федерального державного унітарного підприємства "Державний науково-дослідний інститут особливо чистих біопрепаратів Федерального медико-біологічного агентства", Санкт-Петербург
Корнєва Олена Андріївна– д.м.н., професор, заслужений діяч наук РФ, академік РАН, керівник відділу загальної патології та патологічної фізіології Федеральної державної бюджетної установи «Науково-дослідний інститут експериментальної медицини» Північно-Західного відділення Російської академії медичних наук, Санкт-Петербург
Ліознов Дмитро Анатолійович– д.м.н., професор, завідувач кафедри інфекційних хвороб та епідеміології Державної бюджетної освітньої установи вищої професійної освіти «Перший Санкт-Петербурзький державний медичний університет ім. акад. І.П. Павлова, Санкт-Петербург
Лобзін Юрій Володимирович- д.м.н., професор, з.д.н. РФ, академік РАН, директор Федеральної державної бюджетної установи «Науково-дослідний інститут дитячих інфекцій Федерального медико-біологічного агентства», Санкт-Петербург
Михайлович Владислав Адамович– д.м.н., професор, консультант Санкт-Петербурзького Державного бюджетного закладу охорони здоров'я «Центр з профілактики та боротьби зі СНІД та інфекційними захворюваннями», Санкт-Петербург
Плавінський Святослав Леонідович– д.м.н., професор, завідувач кафедри педагогіки, філософії та права Державної бюджетної освітньої установи вищої професійної освіти «Північно-Західний державний медичний університет ім. І.І. Мечникова», Санкт-Петербург
Рокштро Юрген– (Jürgen Rockstroh), професор медицини Рейнського Бонського університету Фрідріха Вільгельма (нім. Rheinische Friedrich-Wilhelms-Universität Bonn) та керівник ВІЛ-відділення університетської клініки, Бонн, Німеччина
Рудакова Алла Всеволодівна– к.б.н., д.фарм.н., старший науковий співробітник відділу організації медичної допомоги Федеральної державної бюджетної установи «Науково-дослідний інститут дитячих інфекцій» Федерального медико-біологічного агентства, Санкт-Петербург
Рибакова Маргарита Григорівна– д.м.н., професор, завідувач кафедри патологічної анатомії Державної бюджетної освіти закладів вищої професійної освіти «Перший Санкт-Петербурзький державний медичний університет ім. акад. І.П. Павлова; головний патологоанатом Комітету з охорони здоров'я Адміністрації Санкт-Петербурга, Санкт-Петербург
Симбірцев Андрій Семенович- д.м.н., професор, директор Федерального Державного унітарного підприємства "Державний науково-дослідний інститут особливо чистих біопрепаратів Федерального медико-біологічного агентства", Санкт-Петербург
Софронов Генріх Олександрович– д.м.н., професор, завідувач кафедри психіатрії та наркології Державної бюджетної освітньої установи вищої професійної освіти «Північно-Західний державний медичний університет ім. І.І. Мечникова», Санкт-Петербург
Степанова Олена Володимирівна– заступник головного лікаря з медичної частини Санкт-Петербурзького Державного бюджетного закладу охорони здоров'я «Центр з профілактики та боротьби зі СНІД та інфекційними захворюваннями», професор кафедри соціально-значимих інфекцій факультету післядипломної освіти Державної бюджетної освітньої установи вищої професійної освіти «Перший Санкт-Петербурзький Державний університет ім. акад. І.П. Павлова» Міністерства Охорони Здоров'я РФ, Санкт-Петербург
Тайць Борис Михайлович– д.м.н., професор, головний лікар Північної клініки Російсько-фінської клініки «Скандинавія», Санкт-Петербург
Тотолян Арег Артемович– д.м.н., професор, член-кореспондент РАН, заступник директора з наукової роботи Федеральної державної установи науки «Науково-дослідний інститут епідеміології та мікробіології імені Пастера», Санкт-Петербург
Трофімова Тетяна Миколаївна- Д.М.Н., професор, директор науково-клінічного та освітнього центру «Променева діагностика та ядерна медицина» інституту високих медичних технологій медичного факультету Федерального державного бюджетного освітнього закладу вищої професійної освіти «Санкт-Петербурзький державний університет», в.н. с. відділу екологічної фізіології Федеральної державної бюджетної установи «Науково-дослідний інститут експериментальної медицини» Північно-Західного відділення Російської академії медичних наук, Санкт-Петербург
Цинзерлінг Всеволод Олександрович– д.м.н., професор, завідувач лабораторією патоморфології Федеральної державної бюджетної установи «Санкт-Петербурзький науково-дослідний інститут фтизіопульмонології» Міністерства Охорони Здоров'я РФ, професор кафедри патології медичного факультету Федерального державного бюджетного освітнього закладу вищої професійної освіти «Санкт-Петербург », Лікар-консультант центру інфекційної патології на базі ПАТ Клінічної інфекційної лікарні ім. С.П. Боткіна, Санкт-Петербург
Черешнєв Валерій Олександрович– д.м.н., професор, академік РАН Голова Комітету з науки та наукомістких технологій Державної Думи Федеральних Зборів Російської Федерації, Москва
Яковлєв Олексій Авенірович– д.м.н, професор, завідувач кафедри інфекційних хвороб з курсом епідеміології медичного факультету Федерального державного бюджетного навчального закладу вищої професійної освіти «Санкт-Петербурзький державний університет», Санкт-Петербург
Редакційна рада журналуБагненко Сергій Федорович– д.м.н., професор, академік РАН, ректор Державної бюджетної освітньої установи вищої професійної освіти «Перший Санкт-Петербурзький державний медичний університет ім. акад. І.П. Павлова» Міністерства Охорони Здоров'я РФ, Санкт-Петербург
Бєляєва Тамара Володимирівна– д.м.н., професор, професор кафедри соціально-значимих інфекцій факультету післядипломної освіти Державної бюджетної освітньої установи вищої професійної освіти «Перший Санкт-Петербурзький Державний медичний університет ім. акад. І.П. Павлова» Міністерства Охорони Здоров'я РФ, Санкт-Петербург
Гіясова Гузаль Маннапівна- к.м.н., директор Центральноазіатського навчального центру з питань лікування, догляду та підтримки ЛЖВ Міністерства охорони здоров'я Узбекистану, Ташкент, Республіка Узбекистан
Довгих Тетяна Іванівна- д.м.н., професор, лікар вищої категорії, завідувач відділу клініко-діагностичної лабораторії Бюджетної установи охорони здоров'я Омської області «Клінічний діагностичний центр», Київ
Жебрун Анатолій Борисович- д.м.н., професор, член-кореспондент РАН, директор федеральної державної установи науки "Науково-дослідний інститут епідеміології та мікробіології імені Пастера", Санкт-Петербург
Караєв Закір Омар огли– д.м.н., професор, заслужений діяч науки, завідувач кафедри мікробіології та імунології Азербайджанського Медичного Університету (АМУ), Баку, Республіка Азербайджан
Кравченко Олексій Вікторович- д.м.н., професор, провідний науковий співробітник Федерального науково-методичного центру МОЗ Росії з профілактики та боротьби зі СНІД, Москва
Мустафін Ільшат Ганійович- д.м.н., професор, завідувач кафедри біохімії Державної бюджетної освітньої установи вищої професійної освіти "Казанський державний медичний університет" Міністерства охорони здоров'я Російської Федерації; завідувач лабораторії імунології Республіканського центру з профілактики та боротьби зі СНІД та З МОЗ РТ, Казань
Петрова Наталія Петрівна- почесний професор АГІУВ, доцент кафедри інфекційних хвороб Алматинського державного інституту удосконалення лікарів, Алмати, Казахстан
Софронов Генріхович Олександрович- д.м.н., професор, академік РАН, директор Федеральної державної бюджетної установи "Науково-дослідний інститут експериментальної медицини" СЗО РАН, керівник відділу екологічної фізіології, керівник групи екології людини ФДБУ "НДІЕМ" СЗО РАН, Санкт-Петербург
Щербук Юрій Олександрович– д.м.н., професор, член-кореспондент РАМН, заслужений лікар РФ, завідувач кафедри нейрохірургії та неврології медичного факультету Федерального державного бюджетного освітнього закладу вищої професійної освіти «Санкт-Петербурзький державний університет», Санкт-Петербург
Емануель Володимир Леонідович– д.м.н., професор, завідувач кафедри клінічної лабораторної діагностики Державної бюджетної освітньої установи вищої професійної освіти «Перший Санкт-Петербурзький Державний медичний університет ім. акад. І.П. Павлова», Санкт-Петербург
Вступ
1. Імуносупресія та її види
2.Причини розвитку вторинного імунодефіциту
4. Біологія вич
5. Джерело інфекції
Висновок
Література
ВСТУП
У Нині світ переживаєпандемію інфекції, яка називається вірусом імунодефіциту людини (ВІЛ-інфекція), яка завдає людству непоправної шкоди, завдаючи щороку мільйони життів. Розрахункові дані Всесвітньої організації охорони здоров'я вказують, що не менше 15 мільйонів людей вже померло від зараження ВІЛ синдрому набутого імунодефіциту, що розвинулося згодом, і ще не менше 35 мільйонів заражено цим вірусом. Хоча кількість нових випадків зараження в деяких країнах знижується, вірус поширюється на нові території, де знаходить нові жертви.
Усі повинні знати та розуміти, що СНІД піде з нами по життю далі. І для того, щоб вижити, зменшити ризик зараження поширення захворювання, якнайбільше людей у всіх країнах світу мають багато знати про СНІД – про розвиток та клінічні прояви захворювання, його профілактику та лікування, догляд за хворими, психотерапію хворих та інфікованих. СНІД може бути переможений лише в тому випадку, якщо все людство, незважаючи на політичні, расові, національні та інші амбіції, об'єднається та доведе, що Homo sapiens – справді розумна істота, гідна жити на нашій Землі.
Збудник ВІЛ – вірус, мабуть, набутий людиною у приматів, відрізняється низкою особливостей, які забезпечують можливість зберігатися в інфікованому організмі довічно, поступово руйнуючи його захисні, імунні структури.
1. Імуносупресія та її види
Імуносупресія, імунодепресія, або імунодефіцит - все це імунодефіцитні стани - пригнічення імунітету обумовлені випаданням одного або декількох компонентів імунної відповіді або тісно взаємодіючих з ним неспецифічних факторів. Це призводить до ослаблення опірності організму по відношенню до різних інфекційних та неінфекційних захворювань. Імуносупресія буває фізіологічною (необхідною у певних ситуаціях для організму), патологічною (при різних захворюваннях та хворобливих станах) та штучною, що викликається прийомом низки імуносупресивних препаратів або іонізуючими випромінюваннями.
Фізіологічна імуносупресія наголошується при вагітності. Вона необхідна для запобігання імунологічному відторгненню ембріона, який є, по суті, генетично та імунологічно наполовину чужорідним трансплантатом у матці вагітної жінки.
Патологічна імуносупресія відзначається, перш за все, при різних станах вродженого або набутого імунодефіциту, зокрема, при інфікуванні ВІЛ, променевої хвороби та ін.
Штучна імуносупресія застосовується при лікуванні аутоімунних захворювань, трансплантації органів і тканин та ін.
Імунодефіцити можна поділити на первинні та вторинні.
Первинні імунодефіцити - це група захворювань, що характеризується зниженням функції імунної системи, що відбувається на тлі різних генетичних порушень. Трапляються первинні імунодефіцити досить рідко, близько 1-2 випадків на 500 000 осіб.
Первинні імунодефіцити розвиваються через збій у роботі однієї чи кількох ланокімунітету.
З боку клітинної ланки відзначається нестача тих чи інших імунокомпетентних клітин. Система гуморальної відповіді реагує зміною продукції специфічних антитіл. Система фагоцитів-відсутністю чи зниженням здатності до «поїдання» шкідливих субстанцій. Може відзначатись і зниження вмісту в крові компліменту (від лат. complementum – доповнення) – неспецифічного фактора імунного захисту, присутність якого надає сироватці неспецифічної бактерицидної активності. Він бере участь у розпізнаванні антигенів, стимулює активність клітин імунної системи.
Так, наприклад, до імунодефіцитів з порушенням клітинної ланки імунітету відносяться такі хвороби як агамаглобулінемія, синдром Ді-Джоржіо, синдром Віскотта-Олдріча, хвороба Брутона.
Порушення функції мікро та макрофагів спостерігаються під час хронічного гранулематозу, синдром Чедіаку-Хігасі.
Імунодефіцити, пов'язані з порушенням системи компліменту, мають у своїй основі дефіцит синтезу одного з факторів цієї системи. Первинні імунодефіцити є протягом усього життя. Хворі на первинний імунодефіцит, як правило, помирають від різних інфекційних ускладнень.
Побічні імунодефіцити зустрічаються набагато частіше первинних. Зазвичай вторинні імунодефіцити розвиваються і натомість на організм несприятливих чинників довкілля чи різних інфекцій. Як і у випадку первинних імунодефіцитів, при вторинних імунодефіцитах можуть порушуватися або окремі компоненти імунної системи, або вся система в цілому. Більшість вторинних імунодефіцитів (крім імунодефіциту, спричиненого інфекцією вірусом ВІЛ) є оборотними та добре піддаються лікуванню.
2.Причини розвитку вторинного імунодефіциту
Чинники, здатні викликати вторинний імунодефіцит, дуже різноманітні. Вторинний імунодефіцит може бути викликаний як факторами довкілля, і внутрішніми чинниками організму.
У цілому нині, всі несприятливі чинники довкілля, здатні порушити обмін речовин організму, можуть стати причиною розвитку вторинного імунодефіциту. До найбільш поширених факторів навколишнього середовища, що викликають імунодефіцит відносяться забруднення навколишнього середовища, іонізуюче та НВЧ випромінювання, отруєння, тривалий прийом деяких лікарських препаратів, хронічний стрес та перевтома. Всі ці фактори надають комплексний негативний вплив на імунну систему, яка охороняє наш організм від усього «шкідливого», що надходить ззовні або утворюється всередині. Крім того, такі фактори як іонізуюче випромінювання викликають виборчу депресію імунного захисту, пов'язану з пригніченням всіх її функцій, що продукують, і системи кровотворення. Люди, які проживають або працюють в умовах забрудненого навколишнього середовища, частіше хворіють на різні інфекційні захворювання і частіше страждають на онкологічні хвороби. Це безпосередньо з зниженням активності імунної системи.
До внутрішніх факторів, здатних спровокувати вторинний імунодефіцит, належать:
Втрати організмом електролітів, мінералів та білків внаслідок деяких захворювань та синдромів, особливо при діарейному синдромі, частому блюванні та різних дизуричних явищах при патології нирок.
Інтоксикація, що супроводжує багато хронічних захворювань, частіше при уремії та кетоацидозі.
Стрес-синдром на первинному етапі характеризується імуноактивацією, проте досить швидко настає виснаження та вторинна імуносупресія.
Злоякісні новоутворення (пухлини) – порушують діяльність усіх систем організму. Найбільш виражене зниження імунітету спостерігається у разі злоякісних захворювань крові (лейкемія) та при заміщенні червоного кісткового мозку метастазами пухлин. На тлі лейкемії кількість імунних клітин у крові часом підвищується в десятки, сотні та тисячі разів, проте ці клітини нефункціональні і тому не можуть забезпечити нормального імунного захисту організму.
Порушення харчування та загальне виснаження організму також призводить до зниження імунітету. З огляду на загального виснаження організму порушується робота всіх внутрішніх органів. Імунна система особливо чутлива до нестачі вітамінів, мінералів та поживних речовин, оскільки здійснення імунного захисту – це енергоємний процес. Часто зниження імунітету спостерігається під час сезонної вітамінної недостатності (зима-весна).
Аутоімунні захворювання виникають через порушення функції імунної системи. На фоні захворювань цього типу та при їх лікуванні імунна система працює недостатньо і, часом, неправильно, що призводить до пошкодження власних тканин та нездатності подолати інфекцію.
Втрата факторів імунного захисту спостерігається під час сильних втрат крові та її компонентів, особливо при опіках або при захворюваннях нирок. Причиною розвитку цих патологій є значна втрата плазми крові або розчинених у ній білків, частина з яких є імуноглобулінами та іншими компонентами імунної системи (білки системи компліменту, С-реактивний білок). Під час кровотеч втрачається не лише плазма, а й клітини крові, тому на тлі сильної кровотечі зниження імунітету має комбінований характер (клітинно-гуморальний).
Різні ендокринні захворювання (цукровий діабет, гіпотиреоз, гіпертиреоз) призводять до зниження імунітету з допомогою порушення обміну речовин організму. Найбільш виражене зниження імунної реактивності організму спостерігається при цукровому діабеті та гіпотиреозі. При цих захворюваннях знижується вироблення енергії в тканинах, що призводить до порушення процесів поділу та диференціації клітин, у тому числі і клітин імунної системи. З огляду на цукрового діабету частота різних інфекційних захворювань значно підвищується. Пов'язано це не тільки з пригніченням функції імунної системи, але й з тим, що підвищений вміст глюкози у крові хворих на діабет стимулює розмноження бактерій.
Тяжкі травми та операції також протікають зі зниженням функції імунної системи. Взагалі, будь-яке серйозне захворювання організму призводить до вторинного імунодефіциту. Почасти це пов'язано з порушенням обміну речовин та інтоксикацією організму, а частково з тим, що під час травм або операцій виділяються великі кількості надниркових гормонів, які пригнічують функцію імунної системи.
Прийом різних лікарських препаратів та наркотичних засобів має виражену імунодепресивну дію. Особливо виражено зниження імунного захисту під час прийому цитостатиків, глюкокортикоїдних гормонів, антиметаболітів.
Зниження імунного захисту у людей похилого віку, вагітних жінок та дітей пов'язане з віковими та фізіологічними особливостями організму цих категорій людей.
ImmunoDiagnostika.ru› node/59
ВІЛ – вірус імунодефіциту людини, що викликає вірусне захворювання – ВІЛ-інфекцію, остання стадія якої відома як синдром набутого імунодефіциту (СНІД) – на відміну від вродженого імунодефіциту
ВІЛ-інфекція була описана в своєї фінальної стадії, що отримала пізню назву "синдром набутого імунного дефіциту" (СНІД) - Acguired Immunodehiciencu Syndrome (AIDS), в "Щоденному віснику захворюваності та смертності" від 05.06.81, що видається центрами з контролю за хворобами - CDC (США). У черговому звіті ММWR з'явилося повідомлення, що в Лос-Анджелесі 5 молодих гомосексуалістів захворіли на рідкісну форму пневмонії і двоє з них померли. У наступні кілька тижнів додалися нові відомості: ще 4 випадки у Лос – Анжелесі, 6 – у Сан-Франциско, 20 – у Нью-Йорку. У всіх таємниче відмовляла імунна система. У них були важкі запалення легень, зумовлені пневмацистами-мікроорганізмами, які дуже часто мешкають у легенях, але зазвичай не здатні викликати захворювання у «нормальних» людей.
Надалі СНІД було виявлено практично у всіх країнах світу та на всіх континентах.
Виживання після віч інфікування
Імунологічними дослідженнями було встановлено, що у цих пацієнтів різко знижено вміст ЦД4-лімфоцитів (Е-хелперів). У наступні роки були описані множинні опортуністичні інфекції та пухлини, які характерні для імуносупресивних осіб. Ретроспективно було показано, що подібний синдром спостерігався з кінця 70-х років у деяких містах США, Західної Європи та Африки не тільки в популяції гомосексуалістів, а й наркоманів реципієнтів крові та її продуктів, за характером передачі інфекції аналогічний гепатиту Ст.
Цей вірус відноситься до групи ретровірусів, що містять РНК, що мають фермент - зворотну транскриптазу, яка забезпечує в геномі уражених клітин появу дезоксирибонуклеїнової кислоти вірусу з ураженням макрофагів таТ4(СД4)- лімфоцитів з реплекацією в останніх вірусах.
Прогресуюча руйнація імунної системи призводить до розвитку синдрому набутого імунодефіциту (СНІД).
У зв'язку з тим, що при цьому захворюванні присутні ВІЛ-антитіла при різних клінічних проявах ще задовго до розвитку СНІДу, захворювання отримало ще й іншу назву – ВІЛ-інфекція.
Було встановлено, що на початку хвороби може розвиватися грипоподібний синдром, після чого протягом багатьох років люди можуть без серйозних ознак хвороби залишатися «носіями» вірусу, проте поступово імунна система руйнується вірусом, кількість ЦД4-клітин падає, захворювання прогресує.
Спочатку з'являються такі симптоми, як слабкість, нічні поти, втрата ваги, шкірно-слизові порушення та персистуюча генералізована лімфаденопатія (ПГЛ). При подальшому прогресії захворювання розвивається оперізуючий лишай, оральний кандидоз, волосиста лейкоплакія язика та інші. Цей синдром назвали СНІД-з в'язаним комплексом - ССК (AIDS Related Complex - ARC).
Такий комплекс є, як правило, станом, що прогресує надалі до СНІДу.
Надалі опортуністичні інфекції чи пухлини дають картину розгорнутого СНІДу. У деяких випадках безсимптомна ВІЛ-інфекція може швидко прогресувати до СНІДу. Однак на сьогодні відомі практично здорові носії-довгожителі, які живуть із ВІЛ понад 10 років.
Зарубіжними вченими вірус був виділений із багатьох біологічних рідин організму людини. Велика, а тому і найнебезпечніша концентрація вірусу виявлена в крові, в спермі, у вагінальному вмісті жінки та грудному молоці. Вірус виявлений також у слині, сечі і навіть у слізній рідині, але у вкрай низьких концентраціях. У всіх добре вивчених та доведених випадках зараження відбувалося через контакти «кров-кров», «сперма-кров». Найбільша ймовірність зараження коли вірус потрапляє безпосередньо в кров'яне русло.
Практично одразу після перших повідомлень про ВІЛ з'явилася інформація про його надзвичайно високу мінливість. Швидкість генерації помилок у ревертази ВІЛ настільки висока, що у природі, мабуть, немає двох абсолютно ідентичних геномів ВІЛ. Більш того, мінливість у самої варіобельної частини геному, що кодує глікопротеїн оболонки вірусної частки, навіть у одного хворого часто становить 15 відсотків, а відмінності між вірусами, виділеними в різних країнах, досягають часом 40-50 відсотків. Вочевидь, такі високі відмінності що неспроможні зашкодити походах до стратегії розробки вакцини.
Спочатку вірус з'явився в Африці і звідти він потрапив на Гаїті, де все населення африканське і через виняткову бідність легко ставали жертвами сексуальної експлуатації, а потім він проник у США. Дослідники єдині в тому, що одним із епіцентрів поширення СНІДу був Нью-Йорк. Першими хворими в ПАР були два білі гомосексуалісти, які повернулися з відпустки, яку вони провели в Нью-Йорку. Доведено, що перші дев'ять хворих на СНІД у ФРН заразилися в США.
Таємниця СНІДу
З того часу у всьому світі намагаються з'ясувати, звідки ж він з'явився. Висловлюються різні гіпотези, аж до найфантастичніших: наприклад, що ВІЛ – інопланетний вірус. Існує кілька гіпотез, які мають наукове обгрунтування.
У всьому винні мавпи
Найперша і, можливо, найправдоподібніша гіпотеза про природу ВІЛ пов'язана з мавпами; понад 20 років тому її висловив доктор Бетт Корбер із національної дослідницької лабораторії Лос-Аламоса (Нью-Мексико, США). Згідно з цією гіпотезою, попередник ВІЛ потрапив у кров людини від шимпанзе; трапилося це в тридцятих роках минулого століття. Відбутися це могло досить просто - від укусу або при обробці туші вбитої тварини. Свою смертоносну навалу вірус почав із Західної та Екваторіальної Африки. (До речі, якраз у тридцяті роки в Африці відбувалосямасове винищення шимпанзе.) Треба сказати, що гіпотеза Корбера спирається серйозні наукові дослідження. На основі наявної вчених великої бази даних відтворено генеалогічне дерево ВІЛ з точки зору відомих мутацій вірусу. Після цього було написано спеціальну програму, і суперкомп'ютер «Нірвана» розпочав «зворотний відлік». Віртуальний родоначальник вірусу імунодефіциту людини було виявлено у 1930 році. На думку вчених, не виключено, що саме з цієї дати і починається епідемія, яка на сьогоднішній день вразила понад 40 мільйонів людей на планеті. Пізніше в крові шимпанзе дійсно було виявлено рідкісний вірус, здатний при попаданні в організм людини викликати смертельне захворювання. Сенсаційне відкриття зробив доктор Хан при вивченні зразків тканин самки шимпанзе на прізвисько Мерилін, яка загинула при невдалих пологах 15 років тому в науковому центрі ВПС США. Однак шимпанзе є лише носіями смертоносного вірусу, який у них самих хвороб не викликає. Чому так відбувається - поки що загадка. Якщо вдасться зрозуміти, як мавпи навчилися справлятися з інфекцією, створення ефективних ліків проти чуми ХХ століття стане реальністю. Звідки та коли потрапив ВІЛ у людську популяцію? Щоб відповісти на це питання, необхідно згадати про інші лентивіруси приматів, про ВІЛ-2 та численні віруси імунодефіциту мавп (ВІО). Цікаво, що ВІО не викликають СНІД у природних господарів. Зелені мавпи, наприклад, самі не хворіють, проте можуть заражати мавп інших видів, зокрема, при сумісному утриманні у зоопарках. Так, у Японських макак, які ніколи не стикалися з ВІО, розвивається інфекція із симптомами СНІДу, що закінчується летальним кінцем. Виявилося, що ВІЛ-2 близький до одного з мавпячих вірусів, що виділяється в Африці у природних популяціях димчастих мангобеїв. Описано кілька випадків зараження людей, причому у інфікованих розвивалися всі симптоми, що викликаються ВІЛ-2. І навпаки, експериментальне зараження димчастих мангобеїв призводило до розвитку хронічної інфекції без симптомів СНІДу. Можна зробити такий висновок: інфекція, що викликається ВІЛ-2, – типовий зооноз; Природний резервуар вірусу знаходиться у популяції димчастих мангобеїв у Західній Африці. Більше того, є докази, що поява субтипів ВІЛ-2 (всі його варіанти теж поділяються на субтипи - від А до Е), найімовірніше, пов'язане з декількома заносами ВІО до людської популяції. З ВІЛ-1 питання поки що залишається відкритим, хоча за аналогією можна припустити: вірус потрапив до людей від якихось мавп; розвиток симптомів СНІДу пов'язані з тим, що людина - його природний господар. Відомі вже чотири випадки виявлення вірусів, що нагадують ВІЛ-1 у шимпанзе. Три віруси виділені в Західній Африці, а четвертий - у США, у шимпанзе, який живе в зоопарку. Аналіз вірусних геномів дозволив зробити припущення: природним резервуаром ВІЛ-1 може бути один із підвидів шимпанзе Pan troglodytes, який живе на території тих країн Західної Африки, де одночасно виявляються представники всіх груп ВІЛ-1. При цьому вважається: вірус як мінімум тричі "переступав" міжвидовий бар'єр, даючи початок групам "М", "N", "О". Цікаво, що ранній зразок крові, що містить ВІЛ-1 (групи «М»), виявлений у місті Кіншаса (нині столиця Демократичної Республіки Конго), датований 1959 роком. У минулому році американські фахівці, вивчивши генетичні відмінності між вірусом, присутнім у зразком крові сорокарічної давності, і сучасними представниками групи «М», висловили таку думку: загальний попередник усіх субтипів цієї групи міг потрапити до людської популяції від шимпанзе десь близько 1940 року. Однак багато вчених цілком справедливо, на мій погляд, вважають: швидкість еволюції ВІЛ залежить від великої кількості різних факторів, які не були враховані. Отже, хоча походження ВІЛ-1 від мавпових «родичів» не викликає сумнівів, передбачувана дата (1940 рік) не є остаточною і може відсунутись на багато років тому. Відсутність старіших зразків крові, інфікованих ВІЛ, легко пояснити: вірус у той період циркулював у африканських селах, віддалених від медичних центрів. Незрозуміло, чому досі знайдено лише чотири інфікованих шимпанзе. Адже за аналогією з ВІЛ-2 виявлення вірусу в природному резервуарі не повинно представляти скільки серйозної проблеми. Зрештою, залишається відкритим питання, як саме вірус потрапив від мавп до людини. У випадку з ВІЛ-2 все досить зрозуміло: в африканських селах багато мангобеїв - теж, що і російські двірнята, приручені мавпи постійно спілкуються з людьми, граються з дітьми... Більше того, в деяких районах Західної Африки мавп цього виду вживають у їжу . Шимпанзе ж досить рідкісні, які габарити і характер не схильні до дружньому спілкуванню. Доводиться констатувати: або ті шимпанзе - носії вірусу - ще не спіймані, або вірус, що нагадує ВІЛ-1, потрапив до них і людині від якихось інших африканських мавп (можливо, вже вимерлих).
Вірус, що викликає СНІД, набагато старший, ніж вважалося раніше
Все почалося з того, що в заморожених тканинах п'ятнадцятирічного чорношкірого підлітка з гомосексуального середовища, який помер 30 років тому в шпиталі Сент-Луїса, від «невідомої хвороби» виявили ВІЛ. Вірус зразка 1968 року всебічно вивчили та з'ясували дуже цікавий факт: виявилося, що він практично не змінився і надзвичайно схожий на сучасні зразки ВІЛ. Це поставило під сумнів теорію походження ВІЛ від африканських мавп. Професор Роберт Геррі зробив доповідь, в якій заявив, що порівняльні дослідження вірусу 30-ї давності та нинішніх видів дозволяють судити про швидкість мутації ВІЛ: вона значно нижча, ніж передбачалося. За такої швидкості вірус «африканського» типу (ВІЛ-2) не міг за час, що минув з його появи в Африці, перетворитися на форму, виділену в Європі та США (ВІЛ-1). На думку вченого, вірус мутував у організмі людини задовго доспалахи захворювання в Африці – можливо, протягом століть. Іншими словами, СНІД може бути і 100, і навіть 1000 років. Про це, зокрема, свідчить той факт, що саркома Капоші, описана на початку ХХ століття угорським лікарем Капоші як рідкісна форма злоякісного новоутворення, насправді вже тоді вказувала на наявність у хворих на вірус імунодефіциту. Але поки що перевірити цю гіпотезу не вдалося, заморожених зразків тканини чи крові такої давності не збереглося.
ВІЛ існував завжди
Багато дослідників вважають батьківщиною СНІДу в Центральній Африці. Ця гіпотеза поділяється своєю чергою на дві версії. Перша стверджує, що вірус давно існував і циркулював у ізольованих від зовнішнього світу районах, наприклад, у племінних поселеннях, загублених у джунглях. А згодом, коли міграція населення збільшилася, вірус вирвався назовні та почав поширюватися. Це погіршується ще й тим, що африканські міста зараз - найбільш зростаючі у світі. І оскільки більшість людей там голодує, величезна кількість жінок змушена займатися проституцією, яка, своєю чергою, є надзвичайно «благодатним» середовищем для поширення СНІДу. Оскільки в глухих районах африканського континенту тривалість життя не перевищувала 30 років, аборигени, які заразилися ВІЛ, часто гинули ще до того, як у них могло б розвинутись захворювання. У сучасному цивілізованому світі суттєво більшою тривалістю життя вірус помітили – неможливо не замінити хвороби та загибелі людини у віці 30–40 років. Можливо, коли люди житимуть по 200–300 років, відкриється безліч нових, ще не вивчених вірусів, які вбиватимуть «молодих» та «здорових» 135-річних юнаків та дівчат. Просто для їх розвитку у організм людини потрібен ще більшийтермін. Друга версія полягає в тому, що за рахунок багатих покладів урану в деяких районах Африки існує підвищене радіоактивне тло, яке сприяє збільшенню кількості мутацій і відповідно прискоренню видоутворення. Не виключено, що це могло вплинути на появу нових форм вірусу СНІДу, небезпечних для життя людини.
4. Біологія вич
Потрапляючи в організм людини, ВІЛ заражає CD4+ лімфоцити, макрофаги та деякі інші типи клітин. Проникнувши ж у зазначені типи клітин, вірус починає активно розмножуватися. Це в кінцевому рахунку призводить до руйнування та загибелі заражених клітин. Присутність ВІЛ згодом викликає порушення імунної системи через вибіркове знищення ним імунокомпетентних клітин та придушення їх субпопуляції. Віруси, що вийшли з клітини, впроваджуються в нові, і цикл повторюється. Поступово кількість CD4+ лімфоцитів знижується настільки, що організм вже не може протистояти збудникам опортуністичних інфекцій, які не є небезпечними або мало небезпечними для здорових людей з нормальною імунною системою. ВІЛ відноситься до сімейства ретровірусів, роду лентивірусів. Проникаючи в організм людини, ВІЛ заражає CD4+ лімфоцити, макрофаги та інші типи клітин. Присутність ВІЛ згодом викликає порушення імунної системи через вибіркове знищення ним імунокомпетентних клітин CD4+ лімфоцитів та придушення їх субпопуляції. Проникаючи в CD4+ лімфоцити, вірус починає активно розмножуватися. Розмноження вірусу всередині клітини в кінцевому рахунку призводить до її руйнування та загибелі. Віруси, що вийшли з клітини, впроваджуються в нові, і цикл повторюється. Поступово кількість CD4+ лімфоцитів знижується настільки, що організм вже не може протистояти збудникам опортуністичних інфекцій, які не є небезпечними або мало небезпечними для здорових людей з нормальною імунною системою.
Структура та геном
ВІЛ має сферичну форму, яке капсид - конічну. Діаметр вірусу становить прибл. 100 нанометрів (приблизно у 60 разів менше, ніж діаметр еритроциту). Всередині капсиду ВІЛ знаходиться білковонуклеїновий комплекс: дві нитки вірусної РНК, вірусні ферменти (зворотна транскриптаза, протеаза, інтеграза) та білки (p7, Nef, Vif, Vpr). Сам капсид утворений ~2,000 копій вірусного білка p24. Крім того, з капсидомВІЛ-1 (але не ВІЛ-2) зв'язуються ~200 копій клітинного циклофіліну А, який вірус запозичує у зараженої клітини. Капсид ВІЛ оточений матричною оболонкою, утвореною ~2,000 копій матричного білка p17. Матрична оболонка у свою чергу оточена двошаровою ліпідною мембраною, що є зовнішньою оболонкою вірусу. Вона утворена молекулами, захопленими вірусом під час його відгалуження з клітини, в якій він сформувався. У ліпідну мембрану вбудовано 72 глікопротеїнні комплекси, кожен з яких утворений трьома молекулами трансмембранного глікопротеїну (gp41 або TM), що служать «якорем» комплексу, і трьома молекулами поверхневого глікопротеїну (gp120 або SU). За допомогою gp120 вірус приєднується до антиген-CD4 рецептора та Co-рецептора, що знаходяться на поверхні мембрани клітин. gp41 і особливо gp120 інтенсивно вивчаються як цілі розробки ліків і вакцини проти ВІЛ. У ліпідній мембрані вірусу також знаходяться мембранні білки клітин, у тому числі людські лейкоцитарні антигени (HLA) класів І, ІІ та молекули адгезії. Генетичний матеріал ВІЛ представлений двома не пов'язаними нитками позитивної РНК. Геном ВІЛ містить 9000 пар нуклеотидів. Кінці геному представлені довгими кінцевими повторами (LTR), які керують продукцією нових вірусів і можуть активуватися і білками вірусу, і інфікованої білками клітини. 9 генів ВІЛ кодують принаймні 15 білків. Гени gag, pol, і env несуть інформацію про структурні білки вірусу.
pol - кодує ферменти: зворотну транскриптазу, інтегразу та протеазу.
gag - кодує поліпротеїн, що розщеплюється протеазою до p6, p7, p17, p24.
Env - кодує білок gp160, що розщеплюється протеазою gp41 і gp120.
Ще зі школи всім нам добре відоме таке поняття, як кругообіг речовин у природі. Так ось у ВІЛ теж є свій кругообіг, а точніше, його життєвий цикл, який пов'язаний лише з людиною, з певними її клітинами. У навколишньому середовищі без людини вірус безпорадний і швидко гине. Якби сталося таке, що все людство зникло з планети Земля, то тут же зник би і ВІЛ. На сьогоднішній день це єдино можливийХоча, зрозуміло, зовсім нереальний, суто фантастичний спосіб звільнення нашої планети від На ранній стадії ВІЛ-інфекції віруси зазвичай мають більшу спорідненість з макрофагами, тому їх називають М-тропними. Білок оболонки цих вірусів gр120 здатний зв'язуватися одночасно з CD4-рецептором та ССR5-корецептором. На пізніших стадіях ВІЛ набуває спорідненості з Т-клітинами, оскільки білок gр120 видозмінюється і стає здатним зв'язуватися з клітинами, що містять як рецептор SD4, так і рецептор СХСR4. Тому такі віруси називають Т-тропними. Зрозуміло, що ключовий для взаємодії ВІЛ та клітини CD4-білок-рецептор колись виник і існує зараз у деяких типах клітин зовсім не для того, щоб вірусу було зручно в них проникати. Це дуже важливий клітинний білок, який зазвичай бере участь у перших етапах складного процесу передачі сигналів при активації Т-клітин. А ВІЛ просто зумів підібрати «ключ» саме до цього «замку». В результаті в організмі людини атака вірусу йде головним чином саме на СD4-клітини. Основним способом потрапляння ВІЛ всередину таких клітин людини є його фізичне зв'язування як з білком-рецептором, так і з білком-корецептором, розташованими на клітинній оболонці (рис. 3). Вірус іноді порівнюють із гайковим ключем фіксованого розміру: за гайки меншого розміру він не зможе зачепитися, а гайки більшого розміру взагалі не увійдуть до його пазу. Як мовилося раніше, взаємодію вірусу і рецептора лежить на поверхні клітин можна порівняти з ключем і замком. Коли ключ входить у замок - стикування вірусу та клітини відбулася, після чого двері відчиняються. Злиття зовнішньої оболонки вірусу з мембраною клітини-мішені, що відбувається за цим, забезпечує легке проникнення (перетікання) вірусу всередину клітини. При цьому ВІЛ роздягається там: звільняється від своєї оболонки. Потім вірусу, щоб жити і розвиватися, необхідно перекласти свою генетичну інформацію на зрозумілу клітині-хазяїну мову, тобто інформацію, записану в формі полімерної молекули РНК, перетворити на ДНКову форму. Для цього клітина синтезує білок-фермент, закодований у вірусному геномі під назвою «зворотна транскриптаза». Цей фермент і здійснює утворення РНК однониткової ДНК-копії. Потім за допомогою того ж таки ферменту добудовується друга нитка ДНК. І, нарешті, нова двониткова ДНК-копія вірусу за допомогою спеціального вірусного ферменту інтегрази вбудовується всередину ДНК клітини-господаря. Такий стан вірусу отримав назву провірусу. ДНК провірусу має розмір близько 10 тис. пар нуклеотидів (п.н.) та оточена з обох сторін однаковими послідовностями нуклеотидів, званими довгими кінцевими повторами (LTR - скорочено від англ. Long terminal repeats), розміром по 600-700 п.н. кожен. У цих довгих кінцевих повторах містяться всі необхідні для регуляції роботи генів елементи, які й управляють роботою вірусних генів у новому для них місці. не «мовчать» у клітинах, а активно працюють. Після впровадження в ДНК клітини-господаря провірус стає для клітини «рідним», як і власні гени, ДНК-провірус, по суті, є невеликим новим текстом (програмою) у величезному «старому» клітинному ДНКовому тексті. Так вірусна лжепрограма проникає у головний інформаційний центр – апарат клітини. Хоча в людській клітині в 100 тис. разів більше генетичної інформації, ніж у геномі провірусу, який влазить у людський геном, маленький, але хитрий і моторний ВІЛ у зрештою здобуває перемогу надлюдиною. Вважалося, що вірус, перетворившись на провірус, заспокоюється; цю форму іноді називають «вірусом, що покоїться». Але насправді в більшості випадків справа, швидше за все, не зовсім так. Що ж відбувається після утворення провірусу? Оволодівши «штаб-квартирою» клітини-господаря, ВІЛ (тепер уже у формі провірусу) незабаром починає віддавати накази, яким клітина змушена підкорятися. Цей момент називають активацією провірусу. Наскільки неминуче він настає? Провірус, що має й «ріжки» та «ніжки», без довгих сумнівів і роздумів вступає на стежку війни і «бодається» та «танцює». Не усвідомлюючи ще небезпеки, клітина сама надає вірусу всі необхідні хімічні компоненти, всі свої внутрішні резерви для його розвитку та розмноження. Спочатку відбувається транскрипція провірусу, у результаті якої утворюються нові вірусні РНК, т. е. нові геноми. Підкоряючись генетичній програмі ВІЛ, яка тепер стала для її власної клітини, клітина починає синтезувати на вірусній РНК вірусні білки. Оскільки спочатку синтезуються великі молекули-попередники, інший вірусний білок – протеаза – розрізає їх на строго певні блоки. Так клітина активно виробляє різні компоненти вірусу, виснажуючи цим себе. Потім на поверхні клітинної мембрани з цих компонентів відбувається попередня груба «складання» нових вірусних частинок із синтезованих клітиною блоків. Нові віруси готові! Вони «відгалужуються» від клітини, після чого віруси стають «зрілими», здатними інфікувати нові клітини, тобто готовими до штурму нових ліній оборони. Такий життєвий цикл вірусу, який неминуче закінчується смертю інфікованого Т-хелпера. За часом цей цикл (від зв'язування вірусу з клітиною до виходу перших вірусних частинок з інфікованої клітини) становить менше доби (зазвичай від 15 до 20 годин). Швидкість розмноження ВІЛ дуже висока - в організмі інфікованої людини утворюється часом до 10 млрд. нових віріонів на день. Хоча деякі з них гинуть під дією імунної системи, інфікують нові лімфоцити, що залишаються, і цикл реплікації вірусу повторюється. Загальна кількість інфікованих лімфоцитів в організмі ВІЛ-позитивних пацієнтів зазвичай становить від 107 до 109 клітин.
Різновиди ВІЛ
Для вірусу імунодефіциту людини характерна висока частота генетичних змін, що виникають у процесі самовідтворення. Частота виникнення помилок у ВІЛ становить 10-3 - 10-4 помилок/(геном * цикл реплікації), що на кілька порядків більше за аналогічну величину у еукаріотів. Довжина геному ВІЛ становить приблизно 104 нуклеотиди. З цього слід, Що практично кожен вірус хоча б на один нуклеотид відрізняється від свого попередника. У природі ВІЛ існує у вигляді безлічі квазі-видів, будучи при цьому однією таксономічною одиницею. У процесі дослідження ВІЛ таки були виявлені різновиди, які значно відрізнялися один від одного за декількома ознаками, зокрема різною структурою геному. Різновиди ВІЛ позначаються арабськими цифрами. На сьогодні відомі ВІЛ-1, ВІЛ-2, ВІЛ-3, ВІЛ-4.
ВІЛ-1 – перший представник групи, відкритий у 1983 році. Є найпоширенішою формою.
ВІЛ-2 – вид вірусу імунодефіциту людини, ідентифікований у 1986 році. Порівняно з ВІЛ-1, ВІЛ-2 вивчений значно меншою мірою. ВІЛ-2 відрізняється від ВІЛ-1 у структурі геному. Відомо, що ВІЛ-2 менш патогенний і передається з меншою ймовірністю, ніж ВІЛ-1. Зазначено, що люди, інфіковані ВІЛ-2, мають слабкий імунітет до ВІЛ-1.
ВІЛ-3 - рідкісний різновид, про відкриття якого було повідомлено в 1988. Виявлений вірус не реагував з антитілами інших відомих груп, а також мав значні відмінності в структурі геному.
ВІЛ-4 - рідкісний різновид вірусу, виявлений у 1986 році.
Глобальна епідемія ВІЛ-інфекції переважно зумовлена поширенням ВІЛ-1. ВІЛ-2 поширений переважно у Західній Африці. ВІЛ-3 та ВІЛ-4 не відіграють помітної ролі у поширенні епідемії.
У переважній більшості випадків, якщо не зазначено інакше, ВІЛ має на увазі ВІЛ-1.
5. Джерело інфекції
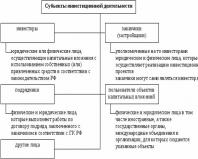
Джерело інфекції - заражена ВІЛ людина, яка перебуває у будь-якій із стадій хвороби.
Основний механізм передачі інфекції – гемоперкутанний (кровоконтактний). Шляхи передачі можуть бути природними, завдяки яким ВІЛ зберігається у природі, та штучними. До природних шляхів передачі відносяться:
1) статевий – при статевих контактах, особливо гомосексуальних;
2) вертикальний - від матері до плоду (дитині), що реалізується як трансплацентарно, так і інтранатально та постнатально (у процесі грудного вигодовування); з іншого боку, існує і загроза інфікування здорової матері при грудному вигодовуванні від зараженої в лікувальному закладі ВІЛ-інфекцією дитини;
3) не виключається (але значно менш ймовірно, ніж при вірусному гепатиті В) побутове парентеральне інфікування через прилади для гоління та інші колюче-ріжучі предмети, зубні щітки і т. п.
Штучний шлях передачі - парентеральний - реалізується при проникненні вірусу через пошкоджену шкіру, слизові оболонки при лікувально-діагностичних маніпуляціях (трансфузії крові та її препаратів, трансплантації органів і тканин, ін'єкції, операції, ендоскопічні процедури, тощо). внутрішньовенному введенні наркотичних речовин, виконанні різноманітних татуювань та обрядових маніпуляціях.
Сприйнятливість до ВІЛ загальна. У нині особливо великий ризикінфікування у наркоманів, які повторно використовують для парентерального введення наркотиків необеззаражені голки та шприци. Контингентами високого ризику зараження ВІЛ є також особи, схильні до гомосексуалізму, проміскуїтету; діти, народжені від ВІЛ-інфікованих матерів; реципієнти донорської крові, тканин та органів, особливо хворі на гемофілію; медичний персонал, який має професійний контакт із кров'ю та іншими біологічними рідинами ВІЛ-інфікованих пацієнтів.
В організмі людини є чотири рідини, якими передається ВІЛ: кров, сперма, вагінальні виділення, грудне молоко. Вірус передається тільки якщо певна кількість рідини зі значною концентрацією вірусу потрапляє в організм і існує можливість потрапляння вірусу безпосередньо в кров.
Незахищений секс.
ВІЛ при сексі передається через контакт рідини, що містять вірус - крові, сперми або вагінальних виділень - зі слизовими оболонками (статевого члена, прямої кишки, піхви і, меншою мірою, рота) або через їхнє безпосереднього потрапляння в кровотік (за наявності ушкоджень). Запобігти передачі вірусу можна, виключивши контакт з перерахованими рідинами. Найбільш поширеним способом цього досягти є використання презервативу.
Вживання ін'єкційних наркотиків
При уколах наркотиків або, інакше кажучи, ін'єкційному використанні психоактивних речовин в організм може потрапити певна кількість крові, яка містить ВІЛ. У використаному шприці чи голці завжди залишається кров, у якій вірус може жити протягом кількох діб. Навіть слідів крові може бути достатньо передачі інфекції.
Тому найефективніший спосіб запобігання передачі вірусу цим шляхом - використання лише стерильного індивідуального одноразового ін'єкційного інструментарію. Важливо розуміти, що йдеться не тільки про шприц з голкою, а про всі предмети, що стикаються з психоактивною речовиною після кип'ятіння розчину.
Ризик передачі вірусу виникає при використанні позичених і раніше вжитих голок та шприців. Небезпечними є купівля препаратів у вже заповненому шприці тарозподіл речовини методом "заправки" (коли розчин вводиться з одного шприца в інший через отвір знятої голки або від витягнутого поршня).
Від матері до дитини
ВІЛ може передаватися дитині від матері під час вагітності, пологів та годування груддю. На кожному з перерахованих етапів цю можливість можна значно знизити. При вагітності ризик передачі вірусу можна зменшити, якщо мати прийматиме спеціальні ліки. Передачі вірусу під час пологів можна уникнути, використовуючи спеціальні методи пологової допомоги. Грудне вигодовування слід замінити штучним.
Ці дії можуть зменшити ризик передачі вірусу від матері дитині до 3-8 відсотків. Тому вагітним жінкам та жінкам, які планують завести дитину, важливо знати свій ВІЛ-статус.
6. Основні форми імунопатологічних процесів
Розлади діяльності імунної системи відбиваються на стані органів та систем, сприяючи виникненню та визначаючи перебіг патологічних процесів: запалення, пухлин, захворювань системи крові, різних інфекцій та інших хвороб. Імунна система визначає імуногенну реактивність організму, порушення якої проявляються у різних формах. Можлива недостатність імунної системи, у результаті виникає зниження чи втрата здатності організму формувати імунні реакції, тобто. виробляти антитіла та імунні лімфоцити. Ці зміни виявляються у формі імунних дефіцитів та імунної толерантності. Разом з тим існують стани, при яких імунна система надзвичайно бурхливо реагує на антигени утворенням антитіл та імунних лімфоцитів. Такі реакції супроводжуються різноманітними та часто небезпечними розладами життєдіяльності. Такі порушення діяльності імунної системи проявляються своєрідним станом, яке називається алергія.
Недостатність імунної системи (імунний дефіцит). Цей стан проявляється ослабленням імунних реакцій та високою схильністю організму до інфекційних, аутоалергічних, онкологічних та інших захворювань. При недостатності імунної системи частота виникнення пухлин, наприклад, зростає у 100-200 разів. Недостатність може торкатися лише одного компонента імунної системи, і навіть мати комбіновані форми. Недостатність імунної системи може бути первинною – спадково обумовленою чи вродженою, та вторинною – набутою після народження у процесі життя.
Вирізняють кілька механізмів розвитку імунодефіцитних станів. Вони можуть виникати в результаті порушеннядозрівання імунних клітин. Цей механізм є основою цілого ряду спадкових, первинних, імунних дефіцитів. Іншим механізмом виникнення недостатності імунної системи є порушення її регулювання. Причинами такого порушення можуть бути надлишок в організмі кортикостероїдів (введення їх при лікуванні певних хвороб, надлишковий синтез при пухлинах надниркових залоз або гіпофіза), збільшення кількості Т-супресорів та зниження кількості Т-хелперів. Припускають, що цей механізм сприяє зниженню протипухлинноїстійкості організму та виникненню пухлин. Навпаки, зниження кількості Т-супресорів та збільшення кількості Т-хелперів можуть сприяти виникненню підвищеної чутливості організму до антигенів (алергія).
Недостатність імунної системи може розвиватися при безпосередньому пригніченні органів імунної системи, наприклад, при іонізуючому навчанні, введенні високих доз препаратів, що пригнічують проліферацію клітин, при старінні.
Однією з найбільш тяжких форм імунного дефіциту є спадкове захворювання, для якого характерна відсутність у кістковому мозку родоначальних стовбурових гемопоетичних клітин. З цих клітин розвиваються і клітини червоної крові, моноцити, і лімфоцити, і тромбоцити, тому при даному захворюванні виникає недостатність всіх компонентів імунної системи. Хворі зазвичай гинуть у ранньому дитячому віці від інфекцій, що протікають виключно тяжко.
Імунна толерантність. Цей стан характеризується відсутністю реакції імунної системи на антиген, у результаті не утворюються специфічні антитіла чи імунні лімфоцити.
Імунна толерантність може бути фізіологічною, патологічною та штучною (лікувальною). Фізіологічна імунна толерантність проявляється переносимістю імунної системи білків свого організму. В основі такої толерантності лежить клонально – селекційний механізм чи «запам'ятовування» клітинами імунної системи білкового складу свого організму. У процесі дозрівання організму відбувається відбір імунних клітин і зберігаються лише ті, які здатні переносити власні білки без утворення проти них антитіл чи імунних лімфоцитів. Тканина мозку, щитовидної залози, внутрішніх статевих органів та кришталика ока у ранньому періоді розвитку організму не має контакту з клітинами імунної системи, і тому імунна система не має толерантності до білків цих тканин. Збереження цих тканин забезпечується їхньою ізоляцією від імунної системи за допомогою гістогематичних бар'єрів. Порушення фізіологічної толерантності до власних білків може виникати внаслідок мутацій клітин імунної системи та появи так званих заборонених клонів імунних клітин, а також внаслідок порушення гістогематичних бар'єрів зазначених вище тканин. Наслідком цих порушень є аутоімунні хвороби.
Прикладом патологічної імунної толерантності є переносимість пухлини організмом. У цьому випадку імунна система слабо реагує на чужорідні за білковим складом ракові клітини, з чим може бути пов'язаний не тільки ріст пухлини, але і її виникнення. Така патологічна толерантність щодо механізму розвитку може бути пов'язана зі збільшенням утворення Т - лімфоцитів супресорів, що послаблюють нормальні імунні реакції. Штучна (лікувальна) імунна толерантність відтворюється за допомогою впливів, що знижують активність органів імунної системи, наприклад, введення імунодепресантів, іонізуючим випромінюванням та ін.
Висновок
Завдяки розробленій терапії, ВІЛ-інфекція із абсолютно смертельного захворювання перейшла до групи хвороб, які вимагають, подібно до діабету, постійного прийому ліків. У США та Західній Європі є сотні осіб, які отримують комбіновану терапію протягом п'яти та більше років, у яких ще не відзначали ознак імунодефіциту, незважаючи на великі терміни від моменту зараження. Як лікування, так і профілактика захворювання вимагають якнайшвидшого впровадження та поширення інформації про ВІЛ-інфекцію та методи боротьби з нею.
Література
1. Адлер, М.Азбука СНІДу / М.Адлер, П.Мортімер, П.Беверлі, К.Саттентду. - М.: Світ, 1991. -
2. Леві, Д.Е. ВІЛ та патогенез СНІДу: Монографія – 3-тє вид., англ. вид. Вид-во: Науковий Світ, 2010. -
3. Покровський, В.В. Епідеміологія та профілактика ВІЛ-інфекції та СНІД. - Вид-во: Медицина, 1996. - 249с.
4. Павуков В.С., Хітров Н.К. Патологія: підручник. - М: Медицина, 1989.
5. otherreferats.allbest.ru ›Медицина ›00129892_0.html
6. aids.rusmedserv.com ›rosvma/treat.html
ВІЛ інфекція- інфекція, що викликається вірусами імунодефіциту людини (ВІЛ), що вражають лімфоцити, макрофаги та нервові клітини. Проявляється повільно прогресуючим імунодефіцитом: від безсимптомного носійства до важких та смертельних захворювань.
Синдром набутого імунодефіциту (СНІД) - вторинний імунодефіцитний синдром, що розвивається в результаті ВІЛ-інфекції. СНІД одна із найбільш клінічно значимих імунодефіцитів. Цей синдром був описаний у науковій літературі 1981 р. американськими дослідниками. Однак ретроспективний аналіз свідчить про те, що СНІД вражав людей і раніше. Перші випадки синдрому офіційно були зареєстровані у США, Африці та на Гаїті. В останні роки, коли були налагоджені методи діагностики СНІДу, з'ясувалося, що кожні 12-14 місяців число зареєстрованих випадків синдрому подвоюється. Щоправда, співвідношення інфікованих осіб (позитивний тест на появу AT до вірусу СНІДу) до хворих коливається від 50:1 до 100:1.
Частота ВІЛ-інфекції.До 2001 р. кількість інфікованихдосягло 130 млн осіб, з них - 35 млн із вираженими проявами СНІДу, що виводить проблему на рівень глобальної катастрофи.
Етіологія ВІЛ-інфекції.Збудники ( віруси імунодефіциту людини[ВІЛ] роду Retrovirus підродини Lentivirinae сімейства Retroviridae) ВІЛ руйнуються при температурі 56°С протягом 30 хв, але стійкі до низьких температур; швидко гинуть під дією етанолу, ефіру, ацетону та дезінфікуючих засобів. У крові та інших біологічних середовищах за звичайних умов зберігають життєздатність протягом кількох діб. Відомо два типи вірусу.
ВІЛ-1(HIV-1)- Основний збудник ВІЛ-інфекції та СНІДу(раніше був відомий як HTLV-III або LAV) у Північній та Південній Америці, Європі, Азії, Центральній, Південній та Східній Африці.
ВІЛ-2(HIV-2)- менш вірулентний вірус; рідко спричиняє типові прояви СНІДу; основний збудник СНІДу у Західній Африці.
Найбільшого поширення на СНІДмає серед чотирьох груп ризику: гомо- та бісексуальних чоловіків; наркоманів, які вводять наркотики внутрішньовенно та користуються колективними шприцами; осіб, яким часто переливають кров (хворі на анемії); дітей батьків, хворих на СНІД.
Епідеміологія ВІЛ-інфекції
Джерело інфекції- людина у будь-якій стадії інфекційного процесу. Вірус виділяють із крові, сперми, вагінального секрету, материнського молока (ці рідини визначають шляхи передачі вірусу), слини. Шляхи передачі – статевий, парентеральний, трансплацентарний, через материнське молоко.
Групи ризику ВІЛ-інфекції.Гомосексуальніі бісексуальні чоловіки(43%), наркомани, які використовують наркотики внутрішньовенно (31%), гетеросексуали (10%), реципієнти крові та її компонентів, трансплантованих органів (2%), хворі на гемофілію (1%).
Патогенез ВІЛ-інфекції.Популяції клітин, уражені ВІЛ
ВІЛ вражає активовані CD4+-клітини (моноцити, макрофаги та споріднені клітини, що експресують CD4-подібні молекули), використовуючи молекулу CD4 як рецептор; ці клітини розпізнають Аг та виконують функції Т-хелперів/ампліфікаторів.
Інфікування можливе при фагоцитозі імунних комплексів, що містять ВІЛ та AT. Зараження моноцитів і макрофагів не супроводжується цитопатичним ефектом і клітини стають персистивною системою для збудника.
Резервуари ВІЛв організмі зараженого індивіда.
Основний резервуар – лімфоїдні тканини. Збудник репродукується постійно, навіть на ранніх стадіях.
У ЦНС – мікроглія.
Епітелій кишківника.
Рання віремічна стадія ВІЛ-інфекції
Вірус реплікується протягом різних проміжків часу у невеликих кількостях.
Тимчасове зменшення загального числа CD4+-клітин та зростання числа циркулюючих ВІЛ-інфікованих CD4+ T-лімфоцитів.
Циркуляцію ВІЛ у крові виявляють у різні терміни; вірусемія досягає піку до 10-20 діб після зараження і продовжується до появи специфічних AT (до періоду сероконверсії).
Безсимптомна стадія ВІЛ-інфекції
Протягом різних періодів часу (до 10-15 років) у ВІЛ-інфікованих симптоми хвороби відсутні. У цей час захисні системи організму ефективно стримують репродукцію збудника.
Гуморальні реакції - синтез AT різних типів, що не здатні надавати протективний ефект і не захищають від подальшого розвитку інфекції.
Клітинні імунні реакції здатні або блокувати репродукцію збудника, або запобігати проявам інфекції. Ймовірно, цитотоксичні реакції домінують у ВІЛ-інфікованих із тривалою відсутністю клінічних проявів.
Імуносупресія при ВІЛ-інфекції
Зменшення кількості циркулюючих CD4+-клітин.Зменшення кількості циркулюючих CD4+ Т-клітин створює умови для реплікації інтегрованого ВІЛ. Реплікацію інтегрованого ВІЛ in vitro активує мітотична чи антигенна стимуляція інфікованих Т-клітин або супутня герпетична інфекція. Можлива причина зменшення числа Т-клітин – прояв цитопатичного ефекту, викликаного реплікацією вірусу. Зараження Т-клітин in vitro не завжди продуктивне; вірусний геном в інтегрованому стані може залишатися неекспресованим протягом тривалого часу, тоді як кількість Т-клітин постійно зменшується. Поява вірусних глікопротеїнів у мембрані заражених Т-клітин – пусковий механізм для запуску імунних процесів, спрямованих проти подібних клітин. Механізми реалізації – активація цитотоксичних Т-клітин та реакція АТ-залежної цитотоксичності. Акумуляція неінтегрованої вірусної ДНК у цитоплазмі інфікованих клітин зумовлює бурхливу реплікацію ВІЛ та загибель клітин.
ВІЛ інфікуєклітини-попередники у тимусі та кістковому мозку, що призводить до відсутності регенерації та зменшення пулу CD4+-лімфоцитів. Зниження числа CD4+-лімфоцитів супроводжується падінням активності ТН1-субпопуляції Т-клітин (проте доказів того, що зростає активність клітин ТН2, немає). Дисбаланс між субпопуляціями клітин TH1 та ТН2 передує розвитку СНІДу. Зменшується активність цитотоксичних Т-клітин та природних кілерів, що пов'язано з дефіцитом хелперів. Відповідь В-клітин також слабшає в міру чисельного скорочення ТН2-субпопуляції. Дефекти гуморальних реакцій різні Аг обумовлені дефіцитом Т-хелперов. В-лімфоцити знаходяться в стані постійної поліклональної активації. Внаслідок поліклональної активації та дефекту регуляторних механізмів В-клітини продукують AT до Аг ВІЛ з низькою специфічністю, що перехресно реагують з ядерними, тромбоцитарними та лімфоцитарними аутоантигенами.
Механізми, що дозволяють ВІЛуникати дії факторів імунологічного нагляду
Підвищена гуморальна анти-ВІЛ-відповідь, ще більш виражена на тлі СНІДу.
Інтеграція геному ВІЛ у ДНК господаря за мінімальної експресії вірусних генів.
Мутації ВІЛ в епітопі gpl20 ВІЛ мутує набагато частіше, ніж більшість інших вірусів, оскільки зворотна транскриптаза ВІЛ працює з помилками і позбавлена активності, що коригує.
Клітинні імунні реакції.
Алергія. Причини та механізми розвитку. Поняття про сенсибілізацію, її роль розвитку алергії.
Алергія (від грец, alios – інший, ergon – дію)- якісно змінена реакція організму на дію речовин антигенної природи, що призводить до різноманітних порушень в організмі – запалення, спазму бронхіального м'яза, некрозу, шоку та інших змін. Отже, алергія – це комплекс порушень, що виникають в організмі при гуморальних та клітинних імунних реакціях.
Етіологія.Причиною алергії можуть бути різні речовини з антигенними властивостями (алергени), які викликають в організмі імунну відповідь гуморального або клітинного типу.
Алергени поділяють на екзо- та ендогенні. Алергенами можуть бути повні антигени та неповні – гаптени. Неповні антигени викликають алергію кількома шляхами:
з'єднуючись з макромолекулами організму, індукують вироблення антитіл, специфічність яких спрямована проти гаптена, а не проти його носія;
формуючи антигенні комплекси із молекулами організму. При цьому антитіла, що утворилися, реагують тільки з комплексом, а не з його компонентами.
Алергія може розвиватися при впливі на організм фізичних чинників і речовин, які є антигенами, лише чинниками, викликають поява антигенів. В даному випадку фізичні фактори (тепло, холод, радіація) та хімічні речовини індукують в організмі утворення алергенів з молекул організму шляхом демаскування прихованих антигенних детермінант або утворення нових антигенних детермінантів в результаті денатурації молекул. З виробленими антитілами демаскуючий або денатуруючий агент не реагує.
Патогенез. Різноманітні клінічні прояви алергічні реакції мають загальні патогенетичні механізми. Розрізняють три стадії алергічних реакцій: імунну, біохімічну (патохімічну) та патофізіологічну, або стадію функціональних та структурних порушень.
Імунна стадія алергічних реакцій.Імунна стадія починається при першій зустрічі організму з алергеном та закінчується взаємодією антитіла з антигеном. У цей період відбувається сенсибілізація організму, тобто підвищення чутливості та набуття здатності реагувати на повторне введення антигену алергічною реакцією. Перше введення алергену називається сенсибілізуючим, повторне, яке безпосередньо викликає прояв алергії, що дозволяє.
Сенсибілізація буває активною та пасивною.
Активна сенсибілізаціярозвивається при імунізації антигеном, коли у відповідь включається власна імунна система. Механізми активної сенсибілізації такі:
Розпізнавання антигену, кооперація макрофагів з Т- та В-лімфоцитами, вироблення плазматичними клітинами гуморальних антитіл (імуноглобулінів) або утворення сенсибілізованих лімфоцитів (Т-ефекторів) та розмноження лімфоцитів усіх популяцій.
Розподіл антитіл (IgE, IgG) в організмі та фіксація їх на клітинах-мішенях, які самі антитіл не виробляють, зокрема, на тканинних базофілах (огрядних клітинах), базофільних гранулоцитах, моноцитах, еозинофілах, а також на тромбоцитах (або взаємодію імуноглобунів) IgG, IgM, IgA) або Т-ефекторів з антигенами, якщо на момент розвитку сенсибілізації вони ще присутні в організмі.
На 7 - 14-й день після введення алергену в сенсибілізуючу дозу організм набуває до нього підвищеної чутливості.
Пасивна сенсибілізаціяздійснюється в неімунізованому організмі при введенні йому сироватки крові, що містить антитіла, або клітинної суспензії із сенсибілізованими лімфоцитами, отриманими від активно сенсибілізованого даним антигеном донора. При цьому стан підвищеної чутливості розвивається через 18 - 24 год. Цей час необхідний для розподілу антитіл в організмі та фіксації їх на клітинах.
Основні типи алергічних реакцій та його характеристика (класифікація Джелла і Кумбса). Бронхіальна астма, поліноз, сироваткова хвороба, набряк Квінке. Загальна характеристика.
Кумбс і Джелл (1968) виділили такі типи алергічних реакцій:
Тип I – реагіновий (анафілактичний). Антитіла сорбовані на клітині, а антигени надходять ззовні. Комплекси антиген-антитіло утворюються на клітинах, що несуть антитіла. У патогенезі реакцій суттєвою є взаємодія антигену з IgE та IgG (реагінами), сорбованими на тканинних базофілах, та подальша дегрануляція цих клітин (рис. 7.3). Система комплементу у своїй не активується. До цього типу реакцій відносять анафілаксію загальну та місцеву. Загальна анафілаксія буває при анафілактичному шоці. Місцева анафілаксія поділяється на. анафілаксію в шкірі (кропив'янка, феномен Овері) та анафілаксію в інших органах (бронхіальна астма, сінна лихоманка).
Тип II – реакції цитолізу, або цитотоксичні реакції. Антиген є компонентом клітини або сорбований на ній, а антитіло надходить у тканини. Алергічна реакція починається в результаті прямої дії антитіл, що ушкоджує, на клітини; активації комплементу; активації субпопуляції В-кілерів; активації фагоцитозу. Активуючим фактором є комплекс антиген-антитіло. До цитотоксичних алергічних реакцій належать дія великих доз антиретикулярної цитотоксичної сироватки Богомольця (АЦС).
Тип III - реакції типу феномену Артюса чи імунних комплексів. Ні антиген, ні антитіло при цьому не є компонентами клітин, і утворення комплексу антиген-антитіло відбувається в крові та міжклітинній рідині. Роль преципітуючих антитіл виконують IgM та IgG. Мікропреципітати зосереджуються навколо судин і в судинній стінці. Це призводить до порушення мікроциркуляції та вторинного ураження тканини, аж до некрозу. IgM, IgG - IgG, активують комплемент, а за допомогою нього - вироблення інших активних речовин, хемотаксис та фагоцитоз. Утворюється лейкоцитарний інфільтрат – уповільнений компонент феномена Артюса.
Тип IV – реакції уповільненої гіперчутливості (ГЗТ). Головна особливість реакцій уповільненого типу у тому, що з антигеном взаємодіють Т-лімфоцити. Реакція сповільненої гіперчутливості не менш специфічна по відношенню до антигену, ніж реакція з імуноглобулінами завдяки наявності у Т-лімфоцитів рецепторів, здатних специфічно взаємодіяти з антигеном. Цими рецепторами є, ймовірно, IgM, укорочені та вбудовані в мембрану Т-лімфоциту, та антигени гістосумісності (див. нижче). Однак у тканині, де відбувається ця реакція, серед багатьох клітин, що руйнують антиген і тканину, виявляється лише кілька відсотків Т-лімфоцитів, здатних специфічно реагувати з антигеном. Цей факт став зрозумілим після відкриття лімфокінів - спеціальних речовин, що виділяються Т-лімфоцитами. Завдяки їм імунні Т-лімфоцити навіть у невеликій кількості стають організаторами руйнування антигену іншими лейкоцитами крові (див. нижче).
Тип V – стимулюючі алергічні реакції. Внаслідок дії антитіл на клітини, що несуть антиген, відбувається стимуляція функції цих клітин. Механізм стимуляції пояснюється тим, що вироблені антитіла можуть реагувати специфічно з рецепторами клітини, призначеними для активуючих гормонів або медіаторів. До стимулюючого типу алергічних реакцій відноситься аутоімунний механізм базедової хвороби, що призводить до гіперфункції щитовидної залози.
Залежно від часу появи реакції після контакту з алергеном розрізняють також алергічні реакції негайного типу (гіперчутливість негайного типу – ГНТ) та алергічні реакції уповільненого типу (гіперчутливість уповільненого типу – ГЗТ) за класифікацією, запропонованою R. A. Cooke (1930). У першому випадку реакція розвивається протягом 15 – 20 хв, у другому – через 1 – 2 добу. Ця класифікація існує і в даний час, проте вона не відображає всієї різноманітності проявів алергій у тому числі патогенетичних особливостей, що лежать в основі класифікації Джелла і Кумбса.
Особливості імунної стадії реакцій уповільненого (клітинного) типу.Т-лімфоцити розпізнають антигенні детермінанти з високим ступенем специфічності за допомогою рецепторів, до складу яких входить антиген головного комплексу гістосумісності МНС.
Гени, що кодують антигени МНС, розташовуються у людини в 6-й хромосомі, є їх 4 алелі, кожен з генів зустрічається в генофонді в множині (десятки) варіантів. Антигени МНС є речовинами, вбудованими в мембрани клітин, у тому числі, у мембрани лейкоцитів, тому їх позначають НLA-A, HLA-B, HLA-C, HLA-D (від англ. Human Leucocytes Antigen – антиген лейкоцитів людини).
За участю імунних реакціях лімфоцитів речовини головного комплексу гістосумісності МНС розділили на дві групи: до групи HI відносяться HLA-A, HLA-B, HLA-C, група НII включає HLA-D. До складу рецепторів Т-кілерів входять речовини групи HI. У тому ж організмі рецептори Т-хелперів містять речовини групи НІ (аллель HLA-D). Встановлено, що клітини організму вбудовують чужорідні антигени у свою мембрану в речовину комплексу МНС, наприклад антигени вірусу при зараженні клітини. Т-лімфоцит може розпізнати чужорідний антиген, якщо ця чужорідна речовина в клітині-носія вбудована в такий же антиген головного комплексу гістосумісності, який має сам Т-лімфоцит, тобто відбувається асоційоване імунне розпізнавання.
Бронхіальна астма.При цьому захворюванні у відповідь на дію алергену розвиваються спазм та набряк слизової оболонки бронхіол, гіперсекреція слизу, що накопичується у бронхах. Порушуються вентиляція легень та газообмін, виникає важка задишка. Приблизно в 50% випадків бронхіальну астму викликає компонент кімнатного пилу, що є вуглеводом - продукт природного або бактеріального розпаду целюлози з бавовни. Цей алерген відсутній у вуличному пилу та пилу порожніх будівель, але виявляється у пилу житлових приміщень. Виявилося також, що у 85% дітей, хворих на бронхіальну астму, алерген виникав з кліща домашнього пилу (Dermatophagoides). В інших випадках бронхіальну астму викликають інші алергени, що містяться в повітрі (пилок рослин, злущений епідерміс, шерсть тварин), речовини, що потрапляють в організм парентерально, а також ентерально, зокрема лікарські препарати - ацетилсаліцилова кислота, антипірин, морфін та ін.
У імунній стадії бронхіальної астми велике значення мають IgE (у хворих на бронхіальну астму збільшено вироблення антитіл цього класу). Антитіла виявлені в бронхіолах, де можуть реагувати з алергеном, що вдихається.
У біохімічній стадії бронхіальної астми важливу роль відіграють ацетилхолін, МРС-А, гістамін, ПГФ2, дефіцит ПГЕ та інші біологічно активні сполуки. Поряд із МРС-А, яка є лейкотрієном Д, тривалий спазм бронхіальних м'язів викликає також фактор активації тромбоцитів (ФАТ).
Під впливом комплексу БАВ відбуваються спазм бронхіол, накопичення в'язкого слизу в їхньому просвіті та набряк слизової оболонки, що призводить до звуження і навіть перекриття просвіту бронхіол.
Має значення також зниження вироблення адреналіну та кортизолу - гормонів, контррегуляторних по відношенню до ацетилхоліну та гістаміну.
Поліноз (від англ. pollen – пилок)- алергічне захворювання, що викликається пилком або ефірними оліями рослин і що характеризується гострими запальними змінами в слизових оболонках, головним чином дихальних шляхів та очей: сінна лихоманка, весняний катар, пилкова ринопатія, бронхіальна астма пилу.
Сироваткова хвороба. Під цією назвою Пірке та Шик у 1905 р. описали патологічні явища, що виникають іноді у хворих після парентерального введення з лікувальною метою чужорідної сироватки. Захворювання може виникнути не тільки після повторного введення сироватки, але й після одноразового первинного її введення. Це буває при введенні великої кількості сироватки, білки якої зберігаються у тканинах до появи антитіл до неї.
Анафілактичний шок. Причини та механізми розвитку. Клінічні прояви. Шляхи профілактики.
Анафілаксія. Портьє та Ріше в 1902 р. відкрили явище анафілаксії - стан зниженої стійкості до дії антигену, що настає в результаті імунізації. Анафілаксія є ефектом, протилежним до профілактики, тобто захисної дії імунізації.
Анафілактична реакція може бути генералізованою (анафілактичний шок) та місцевою (феномен Овері). Анафілактичний шок у класичному експерименті відтворюється у морських свинок, сенсибілізованих кінською сироваткою. Мінімальна сенсибілізуюча доза сироватки дорівнює 10-5 мл (0,07 мкг білка), мінімальна роздільна доза приблизно в 10 разів більше. Через 5 - 10 днів після введення сенсибілізуючої дози у відповідь на внутрішньовенне введення антигену, що дозволяє, може розвиватися анафілактичний шок. Максимальна реакція спостерігається через 2 тижні після сенсибілізуючої ін'єкції.
Механізм анафілактичного шоку (I тип алергічної реакції по Кумбсу і Джеллу) (див. вище) полягає в тому, що після введення сенсибілізуючої дози антигену відбувається вироблення та поширення антитіл, зокрема IgE і IgG, по всьому організму. Антитіла сорбуються на клітинах органів та тканин, насамперед на тканинних базофілах. При введенні роздільної здатності антиген потрапляє в кровотік, а звідти в тканини різних органів, реагуючи з гуморальними антитілами і лімфоцитами. Оскільки імуноглобуліни сорбовані на тканинних базофілах, базофільних гранулоцитах та інших клітинах, починається масивна дегрануляція їх, викид гістаміну, серотоніну, активація інших біологічно активних речовин.
Перебіг анафілактичного шоку в різних видів тварин по-різному. Це пов'язано насамперед з тим, який життєво важливий орган у цього виду уражається більше за інших, тобто є "шоковим" (у собак, наприклад, відбувається спазм сфінктерів печінкових вен і застій крові в печінці). Спостерігається різке зниження артеріального тиску.
У кролів провідною ланкою в патогенезі шоку є спазм легеневих артерій та пов'язане з ним різке розширення правої половини серця.
Картина анафілактичного шоку в людини дуже подібна до проявів анафілаксії у морської свинки - відбувається спазм бронхіол, порушення вентиляції легень, знижується артеріальний тиск, температура тіла, порушується згортання крові.
Концепція "алергічного прориву". Відповідно до концепції "алергічного прориву" [Кац Д., 1989] алергічні реакції анафілактичного типу розвиваються в результаті зриву механізму, що гальмує, який інгібує синтез IgE в здоровому організмі. В експерименті на гризунах цей зрив гальмування синтезу IgE і перетворення поганих продуцентів IgE на високореактивні отримано: при видаленні вилочкової залози; при введенні циклофосфаміду (імунодепресант); при низьких дозах опромінення рентгенівськими променями; за допомогою антисироватки проти Т-супресорів.
Механізми "алергічного прориву". Основою "алергічного прориву", що виражається у виникненні або посиленні алергічних захворювань анафілактичного типу, є збільшення освіти IgE. Збільшення продукції IgE відбувається внаслідок порушення регуляції їхнього синтезу. Відкрито 3 групи механізмів регуляції виробітку IgE. Регуляторні відносини існують між лімфоцитами всередині груп Т-лімфоцитів (Т-Т), В-лімфоцитів (В-В), а також між цими групами (Т-В):
Є багатоланкові регуляторні відносини, що утворюють своєрідні мережеві механізми регуляції. Виявлено 2 мережеві механізми, що гальмують синтез IgE і, отже, алергію анафілактичного типу: один з цих механізмів функціонує між В-лімфоцитами і в кінцевому підсумку призводить до вироблення спеціальної субпопуляції В-лімфоцитів інгібітору синтезу IgE, що отримав назву супрес. Інший механізм призводить до вироблення СФА субпопуляцією Т-лімфоцитів, крім того, між цими субпопуляціями Т-і В-лімфоцитів існують своєрідні кооперативні взаємини з вироблення СФА. Відкрито також два механізми, які знімають обмеження синтезу IgE і таким чином посилюють алергію анафілактичного типу. Один з цих механізмів по лінії В-Т-В призводить до вироблення IgE - індукованого регуляторного інгібітора ЕІР, що гальмує синтез субпопуляцією В-лімфоцитів супресорного фактора алергії (СФА). Інший з мережевих механізмів здійснюється по лінії Т-Т і призводить до синтезу регуляторного медіатора, що отримав назву посилюючого фактора алергії (УФА), який підвищує продукцію IgE, блокуючи субпопуляцію Т-лімфоцитів, що виробляє супресорний фактор алергії СФА.
Механізми прямої дії Т-клітин на В-клітини. Виявлено вироблення певних субпопуляцій Т-лімфоцитів пептидів, які є факторами зв'язування IgE. Цими пептидами Т-лімфоцити в плазматичних клітинах - продуцентах IgE регулюють синтез IgE, так і секрецію імуноглобулінів Е.
Регуляція вироблення імуноглобулінів Е за допомогою глікозилювання факторів зв'язування IgE, що виробляються Т-клітинами: малоглікозильовані фактори зв'язування IgE інгібують продукцію IgE; високоглікозильовані посилюють продукцію IgE.
Профілактика та шляхи лікування алергічних захворювань. Десенсибілізація. Види та механізми десенсибілізації.