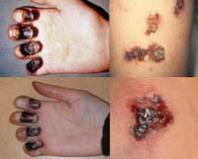
Генна модифікація інфекційних захворювань Все, що слід знати про генну терапію. Стратегії корекції генетичних дефектів
Сьогодні нарешті генна терапіяпочинає виправдовувати надії, що колись на неї покладалися. В останні шість років внаслідок введення специфічних функціональних генів у частині тіла пацієнта вдалося відновити зір у 40 хворих зі спадковою сліпотою. Досягнуто блискучих результатів у боротьбі з різними формами лейкозу: зі 120 піддослідних у кількох хворих досягнуто ремісії, що триває вже три роки. Генна терапія показала свою результативність і у боротьбі з гемофілією – спадковим захворюванням, що іноді призводить до загибелі пацієнта. Тепер хворому не потрібно приймати високих дозахпрепарати, що підвищують згортання крові та мають небезпечні побічні ефекти.
Позитивні результати зустріли з великим ентузіазмом ще й тому, що на генній терапії поставили хрест 15 років тому після передчасної смерті Джессі Гелсінгера (Jesse Gelsinger), підлітка з рідкісним розладом системи травлення. Імунна система юнака відреагувала на введення чужорідного гена так бурхливо, що організм не витримав. Успіхи генної терапії, досягнуті в 1990-ті рр. виявилися далеко не такими вражаючими, як очікувалося.
Все це змусило переглянути деякі з методик, що застосовувалися і більш тверезо оцінити можливості використання генної терапії для усунення різних патологій. Довелося розлучитися з ілюзіями та повернутися до фундаментальним дослідженням. Насамперед потрібно було встановити причину можливих побічних ефектів(на зразок тих, що призвели до загибелі Гелсінгера) і навчитися їх уникати. Більше уваги слід приділяти спілкуванню з хворими та його родичами, щоб прийняте ними рішення було усвідомленим.
Перелом у ситуації стався шість років тому, після того, як за допомогою генної терапії вдалося вилікувати восьмирічного хлопчика на ім'я Корі Хаас (Corey Haas), який страждав дегенеративним захворюваннямочей. Спочатку в результаті генних маніпуляцій у ураженій сітківці лівого ока почав вироблятися недостатній білок, і вже через чотири дні після операції хлопчик побував у зоопарку і до свого неймовірного захоплення зрозумів, що він бачить синє небо та різнокольорові повітряні кульки. Через три роки аналогічні маніпуляції були зроблені з правим оком. Тепер Корі бачить так добре, що може ходити на полювання зі своїм дідусем.
Поки що генна терапія не увійшла до арсеналу практикуючих лікарів, але є надія, що в найближчі десять років це станеться. У 2012 р. у Європі було зроблено спробу застосувати її для усунення рідкісної, але надзвичайно болісної патології, так званого сімейного дефіциту ліпопротеїнліпази. Очікується, що в США дозвіл на використання генної терапії в медицині буде отримано в 2016 р. і тоді вона має надолужити те, що було втрачено за десять років бездіяльності.
Жорстоке розчарування
Невдачі, які спіткали дослідників на ранніх етапах застосування генної терапії на практиці, наочно показали, як важко передбачити всі наслідки введення в організм чужорідних генів. Дуже часто найбезпечніші системи їх доставки виявлялися недостатньо ефективними, а деякі найефективніші – небезпечними: виникає надто бурхлива імунна реакція, як це було у випадку з Гелсінгером або розвивається лейкоз.
Щоб зрозуміти, що стає спусковим гачком для побічних ефектів, і з'ясувати, як зменшити ризик їх виникнення, генетики зосередилися на ретельному вивченні найпоширенішої системи доставки генів: конструюванні вірусів, які діють мікроскопічний шприц для ін'єкцій.
Насамперед із вірусної ДНК було видалено значну її частину, щоб звільнити місце для генів, призначених для введення в організм хворого. (Така процедура одночасно позбавляла вірус здатності до розмноження.) Трансформований вірус, що несе цільові гени, ін'єктували в потрібну частину тіла, де він вбудовував їх у відповідні ділянки клітинної ДНК залежно від типу вірусу.
У той період, коли Гелсінгер брав участь як добровольець у клінічних випробуваннях генної терапії, найпоширенішою системою доставки чужорідних генів в організм людини були аденовіруси, які зазвичай викликають легке інфекційне захворювання верхніх. дихальних шляхів. За даними дослідників з Пенсільванського університету, оптимальний результат дає ін'єкція вірусу в печінку; саме тут знаходяться клітини, що виробляють травний фермент, який був відсутній у Гелсінгера. Функціональну копію гена цього ферменту ввели в інактивовану вірусну частинку та ін'єктували трильйон таких частинок у печінку хворого.
На жаль, деякі частинки потрапили не тільки в клітини печінки, як їм належало, але і в велика кількістьмакрофагів- великих клітин, «сторожових» імунної системи, а також в дендритні клітини, що сповіщають останню про вторгнення чужорідних агентів Імунна система негайно почала руйнувати всі інфіковані клітини, і цей бурхливий процес зрештою занапастив хворого.
Жорсткість імунної відповіді вразила дослідників. У жодного з 17 інших добровольців нічого подібного не спостерігалося. Було відомо, що аденовірус може викликати імунну реакцію, але якщо не вважати інцидент з однією мавпою, якою ін'єктували аденовірус, що трохи відрізняється від описаного вище, то випадок з Гелсінгер був унікальним. «Людська популяція набагато гетерогенніша, ніж популяція тварин, - каже Джеймс Вілсон (James Wilson) з Пенсільванського університету, який розробив систему доставки цільових генів, яку і використовували в клінічних випробуваннях за участю Гелсінгера. - І в нашому випадку один хворий у чомусь суттєво відрізнявся від інших». Можливо, трагедії не сталося б, якби доза вірусу була меншою – не трильйон частинок, а кілька мільярдів. Ще один недолік полягав у тому, що ні сам хворий, ні його родичі не були проінформовані про загибель мавпи в аналогічних випробуваннях, і ніхто не знав, яке рішення вони ухвалили б, якби знали про інцидент.
Трагедія, що сталася з Гелсінгером, не була останньою. Незабаром була спроба усунути за допомогою генної терапії іншу патологію - важкий комбінований імунодефіцит XI (SCID-X1). У випробуваннях брали участь 20 дітей; у п'яти з них розвинувся лейкоз, одна дитина померла. І знову винна була система доставки, хоча в даному випадку використовувався інший вектор - ретровірус, що вбудовує цільові гени безпосередньо в клітинну ДНК. Точне їхнє положення в геномі трохи варіює, і іноді вони включаються поблизу онкогену, що за певних умов призводить до раку.
Перегляд технології
Трагічні наслідки застосування ретро- та аденовірусів як вектори змусили звернутися до інших переносників. В результаті було обрано два віруси.
Перший, аденоасоційований вірус (AAV), не викликає в людини ніяких інфекцій. Більшість із нас у той чи інший період свого життя стають його носіями, і саме завдяки цьому на нього навряд чи відреагує імунна система, коли він виконуватиме функцію вектора. У AAV є ще одна особливість, що допомагає мінімізувати ризик побічних ефектів: він представлений безліччю різновидів (серотипів), кожен з яких воліє інфікувати клітини свого органу або тканини. Так, для AAV2 це очі, для AAV8-печінка, для AAV9-серцевий м'яз і мозок. Можна вибрати різновид вірусу, оптимальну для цільової частини тіла, і мінімізувати імунну відповідь та інші небажані ефекти. Крім того, AAVue включає свій генетичний матеріал у геном клітини-господаря, а тому не може викликати рак, випадково активувавши онкогени.
Аденоасоційований вірус вперше проходив тестування на здатність доставляти генетичний матеріал у необхідні тканини в 1996 р. Випробування проводилися на добровольцях, які страждають на муковісцидоз. З того часу було ідентифіковано 11 серотипів даного вірусу, а з їх компонентів сконструйовано сотні безпечних, селективно діючих векторів. Наразі проходять випробування переносники на основі AAV-вірусів для застосування генної терапії при таких патологіях, як хвороби Паркінсона та Альцгеймера, а також при гемофілії, м'язовій дистрофії, серцевій недостатності та сліпоті.
Другий вірус, як не дивно, – ослаблений варіант вірусу імунодефіциту людини, збудника СНІДу. Забудемо на якийсь час про його погану репутацію і зупинимося на його перевагах як вектора. ВІЛ - член роду Lentivirus сімейства рстровірусів. Він уражає клітини імунної системи і – що дуже важливо – не активує онкогени.
Якщо видалити гени, що відповідають за летальну дію ВІЛ, ми отримаємо чудовий вектор з широкими можливостями. Так вважає Стюарт Нейлор (Stuart Naylor), колишній науковий керівник англійської компанії Oxford Biomedica. На відміну від дрібнішого AAV, «знешкоджений» ВІЛ придатний для перенесення відразу кількох генів. Він нетоксичний і не викликає імунної реакції. Позбавлені здібності викликати інфекцію лентивіруси проходять тестування на можливість застосування для усунення різних патологій, зокрема аденолейкодистрофії. На сьогодні вже кілька хлопчиків із таким діагнозом завдяки генній терапії змогли повернутися до школи.
Паралельно з клінічними випробуваннями із застосуванням AAVn ВІЛ ведеться робота з модифікації старих вірусних векторів для того, щоб їх можна було використовувати за певних обставин. Так, ретровіруси (за винятком ВІЛ) генетично модифікують, щоб вони не викликали лейкозу.
Не відкинуто навіть аденовірус, застосування якого призвело до загибелі Гелсінгера. Його вводять тепер лише ті частини тіла, де він навряд чи викличе імунну реакцію. Одне з можливих його застосувань - генна терапія ксеротомії (сухості у роті) у пацієнтів, які зазнавали опромінення у зв'язку з раком областей голови та шиї. при якому пошкоджуються слинні залози.
Національні інститути охорони здоров'я проводять клінічне випробування (із залученням невеликої кількості добровольців) підходу, заснованого на введенні у відповідні клітини генів, що опосередковують утворення каналів для проходження води у слинні залози. Оскільки останні невеликі за розмірами і більш-менш ізольовані, а доза вірусу в 1 тис. разів менша за ту, що колись отримав Гелсінгер, ймовірність надмірно сильної імунної реакції зведена до мінімуму. Вірусні частинки, які не досягли клітин-мішеней, на думку розробників, повинні руйнуватися в слині, випльовуватися разом з нею або проковтуватися, що зменшує ризик розвитку імунної реакції. За період з 2006 р. у такий спосіб вдалося суттєво покращити стан 11 пацієнтів.
Нові мішені
Натхненні успіхом, медичні генетики розширили сферу застосування генної терапії та спробували з її допомогою усувати генетичні дефекти неспадкового характеру.
Так, у Пенсільванському університеті вже використовують цей підхід у боротьбі з одним з онкологічних захворювань, що найчастіше зустрічаються у дітей, - гострим лімфобластним лейкозом (ALL). Приблизно 20% дітей із таким діагнозом традиційна хіміотерапія не допомагає.
Генна терапія в таких випадках особливо складна і ґрунтується на застосуванні химерних рецепторівантигенів (CAR). Подібно до химерів з давньогрецької міфології, що складаються з частин тіла різних тварин, ці рецептори є комплексом з двох компонентів імунної системи, що в нормі в організмі не зустрічається. Т-клітини, до яких його приєднують, набувають здатності відшукувати специфічні білки, що містяться в лейкозних клітинах у більшій кількості, ніж у нормальних, і руйнувати аномальні клітини. Першими випробуваними були дорослі пацієнти з хронічним лейкозом: отримані результати вселяли оптимізм Результат випробувань на хворих дітях перевершив усі очікування.
Коли в травні 2010 р. Емілі Уайтхед (Emily Whitehead) виявили лейкоз, їй було дев'ять років. Два курси хіміотерапії результату не дали. Навесні 2012 р. провели третій курс, який міг би вбити дорослого, але дівчинка вижила, хоча у неї виникли порушення у нирках, печінці та селезінці. За словами лікаря Брюса Левіна (Bruce Levine). «Емілі була на волосину від смерті».
Тоді в неї взяли кров, виділили Т-клітини та ввели в них лентивірус. геном якого попередньо включили цільові гени. Після ін'єкції химерних Т-клітин назад в організм пацієнтки її стан швидко покращувався. Через три тижні 25% Т-клітин її кісткового мозкубули генетично модифіковані та почали «полювання» на ракові клітини. «У квітні дівчинка повністю облисіла. - Згадує Левін, - а до серпня набула колишній вигляд і була готова до школи ».
Модифіковані Т-клітини навряд чи працюватимуть до кінця її життя, але процедуру завжди можна повторити. А поки ця симпатична дівчинка з густим каштановим волоссям позбавлена від ракових клітин. Восени 2013 р. одразу кілька груп медичних генетиківповідомили про використання CAR-методики для лікування 120 хворих з тією ж формою лейкозу, що у Емілі Уайтхед, а також з іншими формами. У п'ятьох дорослих та 19 з 22 дітей настала ремісія.
Перспективи
Тепер перед фахівцями з генної терапії стоїть чергове завдання: їм потрібно отримати дозвіл Управління контролю якості харчових продуктівта лікарських препаратів (FDA) на застосування своєї безпечнішої, ніж усі колишні, векторної системи в клініці. Необхідно організувати ІІІ фазу клінічних випробувань за участю великої групидобровольців. Зазвичай на це йде від одного до п'яти років. Станом на кінець 2013 р. приблизно 5% із 2 тис. випробувань дійшли до цієї фази. Далі за інших просунулися творці методики лікування за допомогою генної терапії пацієнтів, які страждають на хворобу Лебера (двосторонньою втратою зору, обумовленою мутацією в мітохондріальної ДНК: дана патологіябула у восьмирічного Хааса). Вже кільком десяткам хворих вдалося повернути зір за допомогою генної терапії.
Генна терапія
Баранов В.С. Генна терапія - медицина XXI століття // Соросівський освітній журнал. - 1999. - № 3. - С. 63-68. (Санкт-Петербурзький державний університет)
© Баранов В.С., текст
© Соросівський освітній журнал, 1999
© А. Афонін, обробка та публікація html-версії, 2006
<http:// afonin-59- bio. narod. ru>
<http:// afonin-59- salix. narod. ru>
ВСТУП
Вирішальні досягнення молекулярної біології та генетики у вивченні тонкої структуригенів еукаріотів, їх картування на хромосомах ссавців, і насамперед людини, вражаючі успіхи проекту "Геном людини" в ідентифікації та клонуванні генів, мутації яких призводять до численних спадкових хвороб, і, нарешті, бурхливе зростанняв галузі біотехнології та генної інженерії з'явилися необхідними передумовами для того, щоб від дослідів на тварин і теоретичних побудов уже в 1989 році розпочати перші спроби лікування моногенних хвороб.
Що таке генна терапія? Чи має вона на увазі лікування за допомогою гена як лікарського препарату або тільки лікування шляхом корекції мутантного гена? Ці та багато інших питань неминуче виникають при розгляді такого перспективного, а можливо, і потенційно небезпечного для людства напряму медицини майбутнього XXI століття, як генна терапія.
КОРОТКА ІСТОРИЧНА ДОВІДКА
Генну терапію на сучасному етапіможна визначити як лікування спадкових, мультифакторіальних та неспадкових (інфекційних) захворювань шляхом введення генів у клітини пацієнтів з метою спрямованої зміни генних дефектів або надання клітинам нових функцій. Перші клінічні випробування методів генної терапії були здійснені 22 травня 1989 з метою генетичного маркування пухлинно-інфільтруючих лімфоцитів у разі прогресуючої меланоми. Першим моногенним спадковим захворюванням, щодо якого було застосовано методи генної терапії, виявився спадковий імунодефіцит, зумовлений мутацією в гені аденозиндезамінази. (ADA). 14 вересня 1990 року в Бетесді (США) чотирирічній дівчинці, яка страждає на це досить рідкісне захворювання (1:100000), були пересаджені її власні лімфоцити, попередньо трансформовані поза організмом. (ex vivo) геном ADA (ген ADA + ген пео +вектор ретровірус). Лікувальний ефект спостерігався протягом кількох місяців, після чого процедуру було повторено з інтервалом 3…5 місяців. За три роки терапії загалом проведено 23 внутрішньовенні трансфузії. ADA- трансформованих Т-лімфоцитів без видимих несприятливих ефектів Внаслідок лікування стан пацієнтки настільки покращився, що вона змогла вести нормальний спосіб життя та не боятися випадкових інфекцій. Так само успішним виявилося і лікування другої пацієнтки з цим захворюванням. В даний час клінічні випробування генної терапії цього захворювання проводяться в Італії, Франції, Великій Британії та Японії.
У 1997 році кількість допущених до клінічних випробувань протоколів вже становила 175, понад 2000 пацієнтів взяли участь у їх реалізації. Більшість таких проектів (близько 80%) стосуються лікування онкологічних захворювань та ВІЛ-інфекції (СНІДу). Водночас і в сучасних дослідженнях з генної терапії необхідно враховувати, що наслідки маніпулювання генами чи рекомбінантними ДНК in vivoвивчені недостатньо.
У країнах із найбільш просунутим рівнем досліджень у цій галузі, особливо у США, медичні протоколи з використанням смислових послідовностей ДНК піддаються обов'язковій експертизі у відповідних комітетах та комісіях. У США такими є Консультативний комітет з рекомбінантних ДНК (Recombinant DNA Advisory Committee, RAC) та Управління з ліків та харчових продуктів (Food and DrugAdministration, FDA) з наступним обов'язковим затвердженням проекту директором Національних інститутів здоров'я (National Institutes of Health). У Європі такі протоколи складають та затверджують відповідно до рекомендацій Європейської робочої групи з перенесення генів та генної терапії (European Working Group on HumanGene Transfer and Therapy).
МЕТОДИ ГЕНЕТИЧНОЇ ТРАНСФЕКЦІЇ У ГЕННОЇ ТЕРАПІЇ
Вирішальною умовою успішної генотерапії є забезпечення ефективної доставки, тобто трансфекції (у широкому розумінні) або трансдукції (при використанні вірусних векторів) чужорідного гена в клітини-мішені, забезпечення тривалого функціонування його в цих клітинах та створення умов для повноцінної роботи гена (його експресії) . Трансфекція може проводитися з використанням чистої ("голої" - naked) ДНК, легованої (вбудованої) у відповідну плазміду, або комплексованої ДНК (плазмідна ДНК, сполучена з солями, білками (трансферин), органічними полімерами (DEAE-декстран, полілізин, ліпосомами або частинками золота), або ДНК у складі вірусних частинок, попередньо позбавлених здатності до реплікації.
Основні методи доставки чужорідних генів у клітини поділяються на хімічні, фізичні та біологічні. Ефективність трансфекції та інтеграційна здатність трансдукованої чужорідної ДНК при різних способахтрансфекції в ДНК-клітини мішені неоднакова. Тільки вірусні вектори або генетичні конструкції, що включають вірусні послідовності, здатні до активної трансдукції, а в деяких випадках і тривалої експресії чужорідних генів. З понад 175 вже схвалених протоколів клінічних випробувань з генотерапії понад 120 мають на увазі використовувати вірусну трансдукцію і близько 100 з них засновані на застосуванні ретровірусних векторів.
Огляд даних дозволяє зробити висновок, що, незважаючи на зусилля багатьох лабораторій світу, всі вже відомі та випробувані in vivoі in vitroВекторні системи далекі від досконалості. Якщо проблема доставки чужорідної ДНК in vitroпрактично вирішена, а її доставка в клітини-мішені різних тканин in vivoуспішно вирішується (головним чином шляхом створення конструкцій, що несуть рецепторні білки, у тому числі й антигени, специфічні для тих чи інших тканин), інші характеристики існуючих векторних систем – стабільність інтеграції, регульована експресія, безпека – все ще потребують серйозних доробок.
Насамперед це стосується стабільності інтеграції. До нашого часу інтеграція в геном досягалася лише за використанні ретровірусних чи аденоасоційованих векторів. Підвищити ефективність стабільної інтеграції можна шляхом удосконалення генних конструкцій типу рецептор-опосередкованих систем або шляхом створення досить стабільних епісомних векторів (тобто ДНК-структур, здатних до тривалої персистенції всередині ядер).
Рецептор-опосередковане перенесення генів полягає в наступному. ДНК-послідовність потрібного гена з'єднують з певною речовиною (наприклад, глікопротеїном), який має високу спорідненість до певного мембранного рецептора трансформованої клітини (наприклад, гепатоциту). Отриманий комплекс з'єднують з аденовірусом, який забезпечує проникнення генної конструкції в ядро клітини. Такий комбінований вектор забезпечує ефективну адресну доставку гена певні клітини.
Останнім часом особлива увага приділяється створенню векторів на базі штучних хромосом ссавців (Mammalian Artificial Chromosomes). Завдяки наявності основних структурних елементів звичайних хромосом такі міні-хромосоми довго утримуються в клітинах і здатні нести повнорозмірні (геномні) гени та їх природні регуляторні елементи, які необхідні для правильної роботигена, у потрібній тканині та у належний час.
ПРИНЦИПИ ГЕННОЇ ТЕРАПІЇ
Залежно від способу введення екзогенних ДНК у геном пацієнта генна терапія може проводитися або в культурі клітин (їх vivo),або безпосередньо в організмі (in vivo). Клітинна генна терапія чи терапія ех vivoпередбачає виділення та культивування специфічних типів клітин пацієнта in vitro, введення в них чужорідних генів (наприклад, що посилюють імунну відповідь організму), відбір трансфекованих клонів клітин та реінфузію (введення) їх тому ж пацієнту. В даний час у більшості допущених до клінічних випробувань програм генної терапії використовується саме цей підхід.
Генна терапія in vivoзаснована на прямому введенні клонованих та певним чином упакованих послідовностей ДНК у специфічні тканини хворого. Особливо перспективним для лікування генних хвороб invivoпредставляється введення генів за допомогою аерозольних або ін'єкційних вакцин. Аерозольна генотерапія розробляється, як правило, для лікування пульмонологічних захворювань (муковісцидоз, рак легень).
Розробці програми генної терапії передують ретельний аналіз тканинноспецифічної експресії відповідного гена, ідентифікація первинного біохімічного дефекту, дослідження структури, функції та внутрішньоклітинного розподілу його білкового продукту, а також біохімічний аналіз патологічного процесу Всі ці дані враховуються під час складання відповідного медичного протоколу. Апробацію процедури генокорекції спадкового захворювання проводять на первинних культурах клітин хворого, у яких у нормі функціонально активний цей ген. На цих клітинних моделях оцінюють ефективність обраної системи перенесення екзогенної ДНК, визначають експресію генетичної конструкції, що вводиться, аналізують її взаємодію з геномом клітини, відпрацьовують способи корекції на біохімічному рівні.
Використовуючи культури клітин можна розробити систему адресної доставки рекомбінантних ДНК, проте перевірка надійності роботи цієї системи може бути здійснена тільки на рівні цілого організму. Тому така увага в програмах з генної терапії приділяється експериментам. in vivo на природних чи штучно одержаних моделях відповідних спадкових хвороб у тварин. Успішна корекція генетичних дефектів у таких тварин та відсутність небажаних побічних ефектів генної терапії є найважливішою передумовою для вирішення клінічних випробувань.
Таким чином, стандартна схемагенокорекція спадкового дефекту включає серію послідовних етапів. Вона починається створенням повноцінно працюючої (експресується) генетичної конструкції, що містить смислову (що кодує білок) і регуляторну частини гена. на наступному етапівирішується проблема вектора, що забезпечує ефективну, а, по можливості, і адресну доставку гена в клітини-мішені. Потім проводиться трансфекція (перенесення отриманої конструкції) у клітини-мішені, оцінюється ефективність трансфекції, ступінь коригування первинного біохімічного дефекту в умовах клітинних культур. (in vitro) і, що особливо важливо, in vivoна тваринах - біологічних моделях. Тільки після цього можна розпочинати програму клінічних випробувань.
ГЕНОТЕРАПІЯ МОНОГОНИХ СПАДЩИХ ЗАХВОРЮВАНЬ
Успіх перших клінічних випробувань став потужним стимулом для прискорення розвитку нових генотерапевтичних методів стосовно інших спадковим хворобам. Нижче наведено список хвороб, для яких принципово можливий генотерапевтичний підхід, генокорекція яких з великою ймовірністю буде здійснена вже в найближчому майбутньому, а також ті захворювання, для яких вже є офіційно затверджені протоколи і які знаходяться на різних стадіяхклінічних випробувань.
Таблиця 1– Спадкові захворювання, генокорекція яких перебуває на стадії клінічних випробувань (КІ), експериментальних розробок (ЕР) та принципово можлива (ПВ)
|
Хвороба |
Дефектний ген |
Клітини-мішені |
Стадія |
|
Імунодефіцит |
Аденозиндезаміназа |
Лімфоцити | |
|
Імунодефіцит |
Пуриннуклеозидфосфорілаза |
Лімфоцити | |
|
Сімейна гіперхолестеринемія |
Рецептор ліпопротеїнів низької щільності |
Гепатоцити | |
|
Гемофілія В |
Чинник IX |
Фібробласти | |
|
Гемофілія А |
Чинник VIII |
Міобласти, фібробласти | |
|
Хвороба Гоше (сфінголіпідоз) |
р-глюкоцереброзидаз |
Макрофаги, стовбурові клітини | |
|
Хвороба Хантера |
Ідуронатсульфатаза |
Макрофаги, стовбурові клітини | |
|
Синдром Гурлера |
L-ідуронідаза |
Макрофаги, стовбурові клітини | |
|
Емфізема легень |
α-1-Антитрипсин |
Лімфоцити | |
|
Муковісцидоз |
СГ-трансмембранний регулятор |
Епітелій бронхів | |
|
Фенілкетонурія |
Фенілаланінгідроксилаза |
Гепатоцити | |
|
Гіперамономія |
Орнітинтранскарбамілаза |
Гепатоцити | |
|
Цитрулінемія |
Аргіносукцинатсинтетаза |
Гепатоцити | |
|
М'язова дистрофія Дюшенна |
Дистрофії |
Міобласти, міофібрили | |
|
Таласемія |
β-Глобін |
Еритробласти | |
|
Серповидноклітинна анемія |
β-Глобін |
Еритробласти | |
|
Респіраторний дистрес-синдром |
Сурфактант білок В |
Епітелій бронхів | |
|
Хронічний грануломатоз |
NADPH-оксидаза |
Гранулоцити | |
|
Хвороба Альцгеймера |
Білок – попередник β-амілоїду (ААР) |
Нервові клітини | |
|
Хвороба Паркінсона |
Тирозингідроксилаза |
Міобласти, фібробласти, нервові клітини | |
|
Метахроматична лекодистрофія |
Арилсульфатаза А |
Стовбурові клітини крові, нервові клітини | |
|
Синдром Леш-Ніхана |
Гіпоксантинфосфорибозилтрансфераза |
Нервові клітини |
ГЕНОТЕРАПІЯ НЕСЛІДНИХ ЗАХВОРЮВАНЬ
Одночасно з розвитком досліджень у галузі генокорекції спадкових дефектів успішними також виявилися пошуки методів терапевтичного використання смислових послідовностей ДНК для лікування неспадкових захворювань, та головним чином злоякісних пухлинта вірусних інфекцій. Істотно, що саме в цих розділах патології пошуки шляхів генокорекції проводяться особливо інтенсивно, а кількість схвалених протоколів клінічних випробувань у багато разів перевищує кількість таких для лікування моногенних хвороб.
Нижче наведено основні методологічні підходи до генотерапії різних пухлин, розроблені і вже широко використовуються. Багато з цих підходів цілком придатні і для боротьби з найбільш серйозними інфекційними захворюваннями, наприклад, з ВІЛ-інфекцією (СНІДом).
Результати перших клінічних випробувань цих підходів опинилися в вищого ступеняобнадійливими, особливо в лікуванні нейродегенеративних і онкологічних захворювань нервової системи.
Таблиця 2 -Основні підходи у генокорекції онкологічних захворювань
|
Введені гени |
|
|
Підвищення імунореактивності пухлини |
Гени чужорідних антигенів, цитокінів |
|
Генетична модифікація імунних клітин |
Гени цитокінів, костимуляторів |
|
Інсерція генів "чутливості" або генів "самогубців" |
Гени тимідинкінази HSV, цитозин дезамінази |
|
Блок експресії онкогенів |
Антисмислові Ki-ras мРНК, гени внутрішньоклітинних антитіл |
|
Інсерція генів-супресорів пухлин | |
|
Захист нормальних клітин від хіміотерапії |
Гени лікарської стійкостітип 1 |
|
Індукція синтезу протипухлинних речовин нормальними клітинами |
Гени інтерлейкіну-2, інтерферону |
|
Продукція протипухлинних рекомбінантних вакцин |
Вакцини типу БЦЖ, що експресує пухлинний антиген |
|
Локальна радіопротекція нормальних тканин за допомогою антиоксидантів |
Гени трансферази, глутатіон синтетази |
ДЕЯКІ ЕТИЧНІ ТА СОЦІАЛЬНІ ПРОБЛЕМИ
ГЕННОЇ ТЕРАПІЇ
Поява принципово нових технологій, що дозволяють активно маніпулювати з генами та їх фрагментами та забезпечують адресну доставку нових блоків генетичної інформації до заданих ділянок геному, стала важливою подією в біології та медицині.
Вже зараз на сучасному рівні знань про геном людини теоретично цілком можливі такі його модифікації з метою покращення деяких фізичних (наприклад, зростання), психічних та інтелектуальних параметрів. Таким чином, сучасна наука про людину на своєму новому витку розвитку повернулася до ідеї поліпшення людської породи, колись постульованої видатним англійським генетиком Ф. Гальтоном і розвиненою його учнями та послідовниками у Великій Британії (К. Пірсон, Л. Пенроуз, Дж. Холдейн) , у Росії (Н.К. Кольцов, Ф.П. Філіпченко), у США (Г. Меллер). Подальший хід історії, як відомо, повністю дискредитував саму ідею покращення людської породи. Однак майбутнє всевладдя людини над власним геномом змушує знову і знову повертатися до цієї теми, робить її предметом постійних жвавих дискусій у широкій та науковій пресі. Не викликає сумніву, що початкові побоювання, пов'язані з генною інженерією людини, були невиправдані. Вже визнано доцільним застосування генної терапії на лікування багатьох захворювань. Єдиним і неодмінним обмеженням, що зберігає свою силу і в сучасних умовах, є те, що всі генотерапевтичні заходи мають бути спрямовані лише на конкретного хворого та стосуватися виключно його соматичних клітин.
Сучасний рівень знань не дозволяє проводити корекцію генних дефектів на рівні статевих клітин та клітин ранніх доімплантаційних зародків людини у зв'язку з реальною небезпекоюзасмічення генофонду небажаними штучними генними конструкціями чи внесенням мутацій з непередбачуваними наслідками майбутнього людства. Водночас у науковій літературі дедалі частіше й наполегливіше лунають заклики до відновлення дискусії щодо доцільності генокорекції зародкових та статевих клітин людини.
Ось деякі питання, які мають бути вирішені в рамках пропонованої генетиками широкої дискусії з генної терапії.
1. Чи зможе в майбутньому генна терапія забезпечити таку повноцінну генокорекцію, яка не загрожує потомству?
2. Наскільки корисність і необхідність генотерапевтичної процедури для одного подружжя переважать ризик такого втручання для всього людства?
3. Наскільки виправданими будуть ці процедури на тлі майбутнього перенаселення планети?
4. Як співвідноситимуться генноінженерні заходи на людині з проблемами гомеостазу суспільства та біосфери?
Таким чином, генетична революція, апофеозом якої стала генотерапія, не лише пропонує реальні шляхи лікування важких спадкових і неспадкових недуг, а й у своєму стрімкому розвитку ставить перед суспільством нові проблеми, вирішення яких настійно необхідне вже в найближчому майбутньому.
14943 0
Встановлення локалізації та послідовності гена, мутації якого викликають конкретні захворювання, а також самої мутації та сучасні способиїї тестування дозволяють діагностувати захворювання на нео- і навіть пренатальний періодрозвитку організму. Це дає можливість пом'якшити прояв генетичного дефекту за допомогою медикаментозного лікування, дієти, переливання крові і т.д.
Однак такий підхід не призводить до виправлення самого дефекту і, як правило, спадкові захворювання не виліковуються. Ситуація ускладнюється ще й тим, що мутація одного гена може давати різні наслідки на організм. Якщо мутація гена викликає зміни активності ферменту, який він кодує, це може призвести до накопичення токсичного субстрату або, навпаки, до дефіциту сполуки, необхідної для нормального функціонуванняклітини.
Добре відомим прикладом такого захворювання є фенілкетонурія. Його викликає мутація в гені печінкового ферменту фенілаланіндегідроксилази, що каталізує перетворення фенілаланіну на тирозин. В результаті підвищується рівень ендогенного фенілаланіну в крові, що спричиняє неправильне формування мієлінової оболонки навколо аксонів. нервових клітинцентральної нервової системи та, як наслідок, важку розумову відсталість.
Якщо мутація зачіпає ген структурного білка, це може призводити до серйозним порушеннямлише на рівні клітин, тканин чи органів. Прикладом такого захворювання є кістозний фіброз.
Делеція в гені, що кодує білок, який називається транспортер кістозного фіброзу, призводить до синтезу дефектного білка (відсутність фенілаланіну 508) та порушень транспорту іонів хлору крізь клітинні мембрани. Одним з найбільш шкідливих наслідківцього є те, що слиз, який вистилає та захищає легені, стає ненормально густим. Це ускладнює доступ до клітин легень та сприяє накопиченню шкідливих мікроорганізмів. Клітини, що вистилають повітроносні шляхилегень, гинуть і замінюються фіброзною рубцевою тканиною (звідси назва хвороби). Внаслідок цього пацієнт гине від порушення дихання.
Спадкові захворювання відрізняються складними клінічними проявами, і їхнє традиційне лікування має в основному симптоматичний характер: для лікування фенілкетонурії призначають безаланінову дієту, дефектні білки замінюють функціональним. внутрішньовенним введеннямдля компенсації втрачених функцій проводять трансплантацію кісткового мозку або інших органів. Всі ці заходи, як правило, малоефективні, дорогі, тривалі, і лише небагато пацієнтів доживають до старості. Тому розробка нових видів терапії дуже актуальна.
Генна терапія
Генною терапією називається генетична інженерія соматичних клітин людини, спрямована на виправлення генетичного дефекту, викликає захворювання. Корекція специфічного захворюванняздійснюється шляхом введення в дефектні соматичні клітини нормальних генів, що експресуються. До 80-х рр., коли були розроблені методи отримання окремих генів і створені еукаріотичні вектори, що експресують, стали рутинними експерименти з перенесення генів на мишах, перспективи генної корекції стали реальними.У 1990 р. у США доктором У. Френч Андерсоном (W. French Andrson) було здійснено першу спробу генотерапії для лікування важкого комбінованого імунодефіциту (ТКІД) у трирічної дівчинки Ашанті де Сілва (Ashanthi da Silva). Це захворювання викликається мутацією в гені, що кодує аденозанаденілазу (ПЕКЛО). Дефіцит цього ферменту сприяє накопиченню в крові аденозину та дезоксіаденозину, токсична діяяких призводить до загибелі В- та Т-лімфоцитів периферичної кровіі, як наслідок, імунодефіциту.
Діти з таким захворюванням повинні бути захищені від будь-яких інфекцій (утримуватись у спеціальних стерильних камерах), оскільки будь-яка хвороба може виявитися смертельною. Через 4 роки після початку лікування у дитини спостерігалася експресія нормальної АДА і полегшення симптомів ТКІД, що дозволило їй залишити стерильну камеру і жити нормальним життям.
Таким чином, було продемонстровано принципову можливість успішної генетичної терапії соматичних клітин. Починаючи з 90-х років. проходять випробування генної терапії цілого ряду генетичних захворювань, серед яких такі тяжкі, як гемофілія, СНІД, різні види злоякісних новоутворень, муковісцидоз та ін. Наразіпіддаються лікування за допомогою трансгенезу вже близько 10 хвороб людини.
Розмаїття генетичних захворювань зумовило розвиток багатьох підходів генної терапії. У цьому вирішуються дві основні проблеми: засіб доставки терапевтичного гена; спосіб забезпечення адресної доставки до клітин, призначених для корекції. На сьогодні всі підходи до генної терапії соматичних клітин можна розділити на дві категорії: терапія ex vivo та in vivo (рис. 3.15).
Мал. 3.15. Схема проведення генної терапії ex vivo(а) та in vivo(а)
Генна терапія ex vivo передбачає генетичне виправлення дефектних клітин поза організмом з подальшим поверненням клітин, які нормально функціонують в організм.
Генна терапія in vivo передбачає доставку терапевтичного гена безпосередньо до клітин певної тканини пацієнта. Розглянемо ці підходи докладніше.
Генна терапія ex vivo включає наступні етапи:
1) отримання дефектних клітин хворого та їх культивування;
2) перенесення потрібного гена до ізольованих клітин за допомогою трансфекції терапевтичної генної конструкції;
3) відбір та нарощування генетично виправлених клітин;
4) трансплантація чи трансфузія цих клітин пацієнту.
Використання власних клітин пацієнта гарантує, що після повернення в нього не розвинеться імунна відповідь. Процедура перенесення генної конструкції має бути ефективною, а нормальний ген має стабільно підтримуватися та безперервно експресуватися.
Засобом перенесення генів, створеного природою, є віруси. З метою отримання ефективних векторів для доставки генів переважно використовують дві групи вірусів - аденовіруси та ретровіруси (рис. 3.16). У генній терапії застосовують варіанти генетично знешкоджених вірусів.

Мал. 3.16. Віруси, які застосовуються для створення терапевтичних векторів
Розглянемо пристрій та використання конструкцій на основі ретро-вірусів. Нагадаємо, що геном ретровіруса представлений двома ідентичними одноланцюжковими молекулами РНК, кожна з яких складається з шести ділянок: два довгих кінцевих повтору (LTR) на 5" і 3" кінцях, некодуюча послідовність *Р+, необхідна для упаковки РНК у вірусну частинку, і три ділянки, що кодують структурний білок внутрішнього капсиду (gag), зворотну транскриптазу(pol) та білок оболонки (env) (рис. 3.17, а).

Мал. 3.17. Генетична картатипового ретровірусу (а) та карта ретровірусного вектора (а)
Нагадаємо, що життєвий циклретровірус включає наступні стадії:
1. Інфікування клітин-мішені.
2. Синтез ДНК копії геному за допомогою власної зворотної транскриптази.
3. Транспорт вірусної ДНК у ядро.
4. Вбудовування вірусної ДНК у хромосому клітини-господаря.
5. Транскрипція мРНК з вірусною ДНК під контролем сильного промотора, локалізованого на ділянці 5"-LTR.
6. Трансляція білків Gag, Pol та Env.
7. Утворення вірусного капсиду та упаковки двох РНК-ланцюгів та молекул зворотної транскриптази.
8. Вивільнення віріонів із клітини.
При отриманні ретровірусного вектора повнорозмірну ДНК ретро-вірусу вбудовують у плазміду, видаляють більшу частину гена gag і повністю гени pol і env, а замість них вбудовують «терапевтичний» ген Т і при необхідності маркерний селективний ген Rg з власним промотором (рис. 3.17, б ). Транскрипція гена Т контролюватиметься тим самим сильним промотором, локалізованим на 5"-LTR ділянці. На основі цієї схеми створені різні ретровірусні вектори і максимальний розмір ДНК-вставки приблизно 8 тис. п.о.
Отриману таким чином конструкцію можна використовувати для трансформації, але її ефективність і подальша інтеграція в геном клітини-господаря вкрай низькі. Тому була розроблена методика упаковки повнорозмірної РНК ретровірусного вектора в інтактні вірусні частинки, високою частотоюпроникають у клітину та гарантовано вбудовуються у геном господаря. Для цього було створено так звану «пакуючу» клітинну лінію. В двох різних ділянкаххромосом цих клітин вшиті ретровірусні гени gag і pol-env, позбавлені здатності пакуватися через відсутність послідовності + (84*+) (рис. 3.18).

Мал. 3.18. Схема отримання упакованого вірусного вектора
Тобто обидва ці фрагменти транскрибуються, але утворюються позбавлені РНК порожні капсиди. При трансфекції РНК вірусного вектора в такі клітини вона вбудовується в хромосомну ДНК і транскрибується з утворенням повнорозмірної РНК ретровірусу, і в таких умовах у капсидах упаковується тільки РНК вектора (тільки в ній є +-послідовність). Інтактні вірусні частинки, що утворюються, використовують для ефективної доставки ретровірусного вектора в клітини-мішені.
Ретровіруси активно інфікують тільки клітини, що інтенсивно діляться. Для перенесення генів їх обробляють очищеними частинками упакованого ретровірусного вектора або спільно культивують з виробляє їх клітинною лінією, а потім здійснюють селекцію для поділу клітин-мішеней і клітин, що пакують.
Трансдуковані клітини ретельно перевіряють на рівень синтезу продукту терапевтичного гена, відсутність компетентних реплікації ретровірусів, відсутність змін здатності клітин до зростання або функціонування.
Найбільш придатними щодо генної терапії є клітини кісткового мозку. Це пов'язано з наявністю в ньому тотипотентних стовбурових ембріональних клітин, які можуть проліферувати і диференціюватися в різні типиклітин-В- та Т-лімфоцити, макрофаги, еритроцити, тромбоцити та остеокласти. Саме ці клітини застосовують для лікування цілого ряду спадкових захворювань, серед них вже згаданий нами важкий комбінований імунодефіцит, хвороба Гоше, серповидноклітинна анемія, таласемія, остеопороз та ін.
Крім тотипотентних стовбурових клітин кісткового мозку, які важко виділяти та культивувати, використовують стовбурові клітини з пуповинної крові (переважне використання для генотерапії новонароджених), а також клітини печінки – гепатоцити – для лікування гіперхолестеролемії.
При генній терапії in vivo особливо важливо забезпечити доставку терапевтичного гена до дефектних клітин. Таку адресну доставку можуть забезпечити модифіковані вектори, створені з урахуванням вірусів, здатних інфікувати специфічні види клітин. Розглянемо підхід, розроблений для лікування вже згаданого вище кістозного фіброзу. Оскільки легені є відкритою порожниною, терапевтичні гени до них легко доставити. Клонований варіант здорового гена був введений до інактивованого аденовірусу (рис. 3.19). Специфіка цього вірусу у тому, що він інфікує вистилку легень, викликаючи застуду.

Мал. 3.19. Схема отримання вектора на основі аденовірусу
Сконструйований таким чином вірус відчували, розпорошуючи його в ніс і легені експериментальних тварин, а потім людей-пацієнтів. У деяких випадках спостерігалося введення та експресія здорового гена та відновлення нормального перенесення іонів хлору. Можливо, цей підхід (введення нормального гена за допомогою носових аерозолів) у найближчому майбутньому буде широко використовуватися для лікування симптомів кістозного фіброзу в легенях.
Крім ретро-і аденовірусів в експериментах з генної терапії використовують інші типи вірусів, наприклад вірус Herpes simplex. Особливістю цього двониткового (152 тис. п.о.) ДНК-вірусу є його здатність специфічно вражати нейрони. Відомо безліч генетичних захворювань, що вражають центральну та периферичну. нервову систему- пухлини, метаболічні порушення, нейродегенеративні захворювання(Хвороба Альцгеймера, хвороба Паркінсона).
Вірус простого герпесу I типу (HSV) є дуже відповідним вектором для терапії таких захворювань. Капсид цього вірусу зливається з мембраною нейрона, та його ДНК транспортується в ядро. Запропоновано кілька способів перенесення терапевтичного гена за допомогою HSV-векторів та проведено успішні випробування на експериментальних тваринах.
Вірусні вектори мають кілька недоліків: висока вартість, обмежена ємність, що клонує, і можлива запальна реакція. Так, в 1999 р. в результаті надзвичайно сильної імунної відповіді на введення аденовірусного вектора, що розвинулася, загинув 18-річний доброволець, який брав участь у випробуваннях препарату. У 2002 р. у двох дітей у Франції під час лікування від імунодефіциту (введенням терапевтичних генів у стовбурові клітини за допомогою ретровірусів) розвинувся стан, схожий на лейкемію.
Тому розробляються невірусні системи доставки генів. Найпростіший і неефективний спосіб – це ін'єкція плазмідної ДНК у тканині. Другий підхід – це бомбардування тканин мікрочастинками золота (1-3 мкм), кон'югованими з ДНК. При цьому терапевтичні гени експресуються в тканинах-мішенях та їх продукти – терапевтичні білки – надходять у кров. Основним недоліком цього підходу є передчасна інактивація чи руйнація цих білків компонентами крові.
Доставку ДНК можна здійснити, запакувавши її в штучну ліпідну оболонку. Отримані таким чином сферичні частинки-ліпосоми легко проникають через клітинну мембрану. Створено ліпосоми з самими різними властивостямиОднак поки ефективність такої доставки невисока, оскільки більша частина ДНК піддається лізосомному руйнуванню. Також для доставки генетичної конструкції синтезують кон'югати ДНК з різними молекулами, здатними забезпечити її збереження, адресну доставку та проникнення в клітину.
У Останніми рокамипроводяться інтенсивні експерименти зі створення штучної 47-ї хромосоми, яка б дозволила включити велика кількістьгенетичного матеріалу з повним набором регуляторних елементів для одного або кількох терапевтичних генів Це дало б можливість використовувати геномний варіант терапевтичного гена і тим самим забезпечити його стабільність та ефективну тривалу експресію. Проведені експерименти показали, що створення штучної хромосоми людини, що містить терапевтичні гени, цілком реальне, проте поки що незрозуміло, яким чином вводити таку величезну молекулу в ядро клітини-мішені.
Основними проблемами, які стоять перед генною терапією, крім ризику важкої імунної реакції, є труднощі тривалого зберігання та функціонування терапевтичної ДНК в організмі пацієнта, мультигенність багатьох хвороб, що робить їх важкою мішенню для генної терапії, а також ризик використання вірусів як векторів.
Н.А. Воїнів, Т.Г. Волова
Генна терапія - одна з областей медицини, що стрімко розвиваються, яка передбачає лікування людини за допомогою введення в організм здорових генів. Причому, як стверджують вчені, за допомогою генної терапії можна додати недостатній ген, виправити або замінити його, покращивши тим самим роботу організму на клітинному рівніта нормалізувавши стан хворого.
За словами вчених, потенційними кандидатами на генну терапію на сьогоднішній день є 200 млн. жителів планети, причому ця цифра неухильно зростає. І дуже втішно, що кілька тисяч пацієнтів вже отримали лікування від невиліковних недуг у рамках випробувань.
У цій статті розповімо про те, які завдання ставить перед собою генна терапія, які захворювання можна лікувати цим методом та з якими проблемами доводиться стикатися вченим.
Де застосовується генотерапія
Спочатку генна терапія була задумана для боротьби з тяжкими спадковими захворюваннями, такими як хвороба Хантінгтона, муковісцидоз (кістозний фіброз) та деякими інфекційними зараженнями. Однак 1990-й рік, коли вченим вдалося скоригувати дефектний ген, і, ввівши його в організм хворого, перемогти муковісцидоз, став воістину революційним у галузі генної терапії. Мільйони людей у всьому світі отримали надію на лікування захворювань, які раніше вважалися невиліковними. І нехай така терапія знаходиться біля витоків розвитку, її потенціал викликає подив навіть у науковому світі.
Так, наприклад, крім кістозного фіброзу, сучасні вчені досягли успіхів у боротьбі з такими спадковими патологіями, як гемофілія, ензимопатія та імунодефіцит. Більше того, лікування генами дозволяє боротися з деякими онкологічними захворюваннями, а також з патологіями серця, хворобами нервової системи та навіть травмами, наприклад, з ушкодженнями нервів. Таким чином, генна терапія займається захворюваннями з вкрай важким перебігом, які призводять до ранньої смертностіі, найчастіше, немає іншого лікування, крім терапії генами.
Принцип лікування генами
Як діючу речовину лікарі використовують генетичну інформаціюа якщо бути точним, молекули, які є носіями такої інформації. Рідше при цьому застосовують нуклеїнові кислоти РНК, а частіше – клітини ДНК.
Кожна така клітина має так званий «ксерокс» – механізм, за допомогою якого вона переводить генетичну інформацію в білки. Клітина, яка має правильний ген і без збоїв працює «ксерокс», з точки зору генної терапії є здоровою клітиною. Кожна здорова клітина має цілу бібліотеку оригінальних генів, які вона використовує для правильної і злагодженої роботивсього організму. Однак якщо з якоїсь причини важливий ген загублений, відновити таку втрату неможливо.
Це стає причиною розвитку серйозних генетичних захворювань, таких як міодистрофія Дюшена (при ній у хворого прогресує м'язовий параліч, і він у більшості випадків не доживає до 30 років, помираючи від зупинки дихання). Або менш фатальна ситуація. Наприклад, «поломка» певного гена призводить до того, що білок перестає виконувати свої функції. І це стає причиною розвитку гемофілії.
У кожному з наведених випадків допоможе приходить генна терапія, завданням якої є доставити нормальну копію гена в хвору клітину і підкласти до її клітинний «ксерокс». У цьому випадку налагодиться робота клітини, а можливо, відновиться функціонування всього організму, завдяки чому людина позбавиться від тяжкої недугиі зможе продовжити своє життя.

Які хвороби лікує генна терапія
Наскільки реально допомагає людині генна терапія? За підрахунками вчених, у світі налічується близько 4200 захворювань, що виникають у результаті неправильної роботигенів. У цьому плані потенціал цього напряму медицини просто неймовірний. Однак набагато важливіше те, чого на сьогоднішній день вдалося досягти медикам. Безумовно, на цьому шляху вистачає труднощів, проте вже сьогодні можна виділити низку локальних перемог.
Наприклад, сучасні вчені розробляють підходи до лікування ішемічної хвороби серця у вигляді генів. Адже це неймовірно поширене захворювання, яке вражає набагато більше людей, ніж уроджені патології. Зрештою, людина, яка зіткнулася з ішемічною хворобою, виявляється в такому стані, коли єдиним порятунком для неї може стати генна терапія.
Більше того, на сьогоднішній день за допомогою генів лікуються патології, пов'язані з ураженням центральної нервової системи. Це такі захворювання, як бічний аміотрофічний склероз, хвороба Альцгеймера або хвороба Паркінсона Що цікаво, для лікування перелічених недуг використовуються віруси, які мають властивість атакувати нервову систему. Так, за допомогою вірусу герпесу в нервову систему доставляють цитокіни та фактори росту, що уповільнюють розвиток захворювання. Це яскравий прикладтого, як патогенний вірус, який зазвичай викликає хворобу, обробляється в лабораторних умовах, позбавляючись білків, що несуть захворювання, і використовується як касета, яка доставляє в нерви цілющі речовини і тим самим діє на благо здоров'я, продовжуючи життя людини.
Ще одним важким спадковим захворюванням є холестеринемія, яка призводить організм людини до нездатності регулювати холестерин, внаслідок чого в організмі накопичуються жири, і зростає ризик інфарктів та інсультів. Щоб упоратися з цією проблемою, фахівці видаляють хворому частину печінки та виправляють пошкоджений ген, зупиняючи подальше накопичення холестерину організмом. Після цього виправлений ген поміщають у знешкоджений вірус гепатиту, і за його допомогою відправляють у печінку.
Читайте також:
Є позитивні зрушення й у боротьбі зі СНІДом. Адже не секрет, що СНІД викликається вірусом імунодефіциту людини, яка руйнує імунну системута відкриває ворота до організму смертельно небезпечних захворювань. Сучасні вчені вже знають, як змінити гени, щоб вони перестали послаблювати імунну систему, а почали зміцнювати її для протидії вірусу. Такі гени вводяться через кров за допомогою її переливання.
Працює генна терапія та проти ракових захворювань, зокрема, проти раку шкіри (меланоми). Лікування таких пацієнтів передбачає запровадження генів із чинниками некрозу пухлини, тобто. генів, що містять протипухлинний білок. Більше того, сьогодні проводяться випробування лікування раку мозку, де хворим пацієнтам вводять ген, що містить інформацію щодо збільшення чутливості злоякісних клітин до застосовуваних препаратів.
Хвороба Гоше є найважчим спадкове захворювання, Яке викликається мутацією гена, що пригнічує виробництво особливого ферменту - глюкоцереброзідази У осіб, які страждають від цієї невиліковної недуги, збільшена селезінка та печінка, а з прогресуванням недуги починають руйнуватися кістки. Вченим вже сьогодні вдалися досліди щодо введення в організм таких пацієнтів гена, що містить інформацію щодо вироблення даного ферменту.
А ось ще один приклад. Не секрет, що осліпла людина на все життя позбавляється можливості сприймати зорові образи. Однією з причин вродженої сліпоти вважається так звана атрофія Лебера, яка є генною мутацією. На сьогоднішній день вчені повернули 80 сліпим людям зорові здібності за допомогою модифікованого аденовірусу, який доставив «робочий» ген у тканини ока. До речі, кілька років тому вченим вдалося вилікувати дальтонізм у піддослідних мавп шляхом впровадження в сітківку ока тваринного здорового людського гена. А нещодавно така операція дозволила вилікувати дальтонізм першим пацієнтам.
Що характерно, метод доставки генної інформаціїза допомогою вірусів є оптимальним, тому що віруси самі знаходять свої цілі в організмі (вірус герпесу обов'язково знайде нейрони, а вірус гепатиту - печінка). Однак у даного методу доставки генів є суттєвий недолік - віруси імуногени, а значить, при попаданні в організм можуть бути знищені імунітетом до того, як встигнуть спрацювати, а то й викличуть потужні імунні відповіді організму лише погіршивши стан здоров'я.
Існує й інший спосіб доставки генного матеріалу. Це кільцева молекула ДНК чи плазміда. Вона відмінно спіралізується, стаючи дуже компактною, що дозволяє вченим «упакувати» її в хімічний полімер та впровадити у клітину. На відміну від вірусу, плазміда не викликає імунної реакції організму. Однак цей спосіб менш сприятливий, т.к. через 14 днів плазміда видаляється з клітини та продукція білка зупиняється. Тобто, таким способом ген необхідно вводити протягом тривалого часу, поки клітина «одужуватиме».
Таким чином, у сучасних учених є два потужні методи доставки генів до «хворих» клітин, причому використання вірусів виглядає кращим. У будь-якому випадку остаточне рішення щодо вибору того чи іншого методу обирає лікар, виходячи з реакції організму пацієнта.
Проблеми, з якими стикається генотерапія
Можна зробити певний висновок у тому, що генна терапія – маловивчена область медицини, що з великою кількістю невдач і побічних ефектів, й у її величезний недолік. Однак є ще й етичне питанняадже багато вчених виступають категорично проти втручання у генетичну будову людського організму. Саме тому сьогодні існує міжнародна заборона на використання в генотерапії статевих клітин, а також доімплантаційних зародкових клітин. Зроблено це для того, щоб запобігти небажаним генним змінам і мутаціям у наших нащадків.
В іншому ж генна терапія не порушує жодних етичних норм, адже вона покликана боротися з важкими і невиліковними захворюваннями, в яких офіційна медицина просто безсила. І в цьому найголовніша перевага лікування генами.
Бережіть себе!